
题目列表(包括答案和解析)
5. 下列各组稀溶液,不用其他试剂或试纸,仅利用溶液间的相互反应,就可以将它们区别开的是( )
A.硝酸钾 硫酸钠 氯化钙 氯化钡 B.硫酸 硫酸铝 氯化钠 氢氧化钠
C.盐酸 硫酸钠 碳酸钠 氢氧化钠 D.硫酸氢钠 硫酸镁 碳酸钠 氢氧化钠
解析:选项B中的硫酸铝和氢氧化钠两种溶液反应可生成白色沉淀,此沉淀分别与硫酸、氢氧化钠溶液反应会消失,而且,将硫酸铝与氢氧化钠混合时,如果将前者滴入后者,由于氢氧化钠过量,开始无沉淀产生,随着滴入的硫酸铝逐渐增加,后来逐渐有沉淀生成;反之,若将氢氧化钠滴入硫酸铝中,则生成的沉淀逐渐增多,直至最高限量沉淀又逐渐溶解,这样,将不难区别氢氧化钠和硫酸铝两种溶液。将硫酸和氯化钠两种溶液分别滴入氢氧化铝中,从而可使氢氧化铝溶解即能从中区别出硫酸,可见,选项B为本题答案。
答案:B
4.如图是实验室常见的气体制取、干燥和收集装置。若用过氧化氢和催化剂二氧化锰制取干燥的氧气,则合理的装置组合为( )
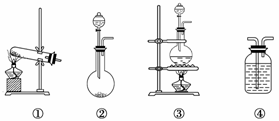
A.①⑤⑧ B.③④⑦ C.②⑤⑥ D.②④⑧
解析:根据题给试剂的状态和反应条件,发生装置应为②;因需制取干燥的O2,④⑤均可作干燥装置;收集装置只能选用⑥,故正确的组合应为②⑤⑥或②④⑥。
答案:C
3.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
解析:此题的主要目的是:既除去原混合溶液中的Ba2+,但又不能引入新的杂质(如Na+ 或SO)。解题思路如下:
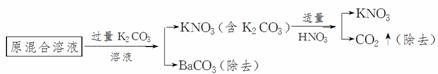
答案:D
2.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液中,无明显现象发生,据此可推断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
解析:乙白色沉淀沉淀溶解,乙为Al2(SO4)3,丁为NaOH,甲无现象,甲:BaCl2,则丙为FeSO4。
答案:D
1.现有三组实验:①除去混在植物油中的水;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
解析:植物油和水互不相溶,应采用分液法分离;碘易溶于CCl4,故用蒸馏法分离;用酒精浸取中草药中的有效成分,利用萃取反应物质。
答案:C
21. (2009·滨州10月模拟)(1)已知液氨中存在着平衡2NH3 NH+NH。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
NH+NH。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
(2)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明:
加酸时:NH3·H2O+H+ NH+H2O
NH+H2O
加碱时:NH+OH- NH3·H2O
NH3·H2O
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中c(H+)与c(OH-)基本保持不变。
含有一定的NaH2PO4和Na2HPO4的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时: ;
加碱时: 。
解析:(1)已知氨水中存在着电离平衡2NH3 NH+NH,加入CsOH会生成CsNH2,从而释放出更多的NH和OH-,在特殊的吸水剂条件下,这两种离子生成N4、H2和H2O,故可得总反应方程式为:8NH3+4CsOH===N4+4CsNH2+6H2↑+4H2O。
NH+NH,加入CsOH会生成CsNH2,从而释放出更多的NH和OH-,在特殊的吸水剂条件下,这两种离子生成N4、H2和H2O,故可得总反应方程式为:8NH3+4CsOH===N4+4CsNH2+6H2↑+4H2O。
(2)依据信息提示:加H+时HPO结合H+生成H2PO;加OH-时H2PO结合OH-生成HPO,从而使溶液的pH保持相对稳定,故称为缓冲溶液。
答案:(1)8NH3+4CsOH===N4+4CsNH2+6H2↑+4H2O
(2)HPO+H+ H2PO
H2PO
H2PO+OH- HPO+H2O
HPO+H2O
20.人体胃液中含有胃酸(0.2%-0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内。当胃酸过多时就会出现“咯酸水”、“烧心”、“胃部隐隐作痛”等症状,严重时会降低食欲,引起消化不良等。当胃酸过多时,医生通常用“小苏打片”、“胃舒平”给病人治疗(小苏打片的成分是碳酸氢钠,胃舒平中则含有氢氧化铝)。
(1)写出用“小苏打片”治疗胃酸过多时反应的离子方程式: 。
(2)有人用土法治疗胃酸过多病,方法是:将鸡蛋皮洗净、烤焦、磨细服用。据说这种疗法效果还不错。请用学过的知识分析其中的化学道理。
。
(3)如果病人同时患有胃溃疡,此时最好服用胃舒平,反应的离子方程式为: 。
(4)氢氧化钠也能中和胃酸,可以服用少量氢氧化钠来治疗胃酸过多病吗? 。
(5)写出NaOH溶液分别与“小苏打”、“胃舒平”溶液反应的离子方程式: 。
解析:用化学知识解释、解决生活、社会问题很好地体现了新课程的STSE理念,是今后高考的命题趋势。在给定的新情境下,按题目要求能够熟练地写出离子方程式。NaHCO3、Al(OH)3都既与强酸反应,又与强碱反应,Al(OH)3和HCO在离子方程式中不可拆写。
答案:(1)HCO+H+===CO2↑+H2O (2)鸡蛋皮中含CaCO3,洗净是为了除杂物,烤焦主要是杀菌、消毒,服用后CaCO3与HCl反应起到了降低HCl浓度的作用。CaCO3+2H+===Ca2++CO2↑+H2O (3)Al(OH)3+3H+===Al3++3H2O (4)不能,NaOH虽然能中和胃酸,但它有强腐蚀性,故不能服用NaOH治疗胃酸过多病。 (5)OH-+HCO===H2O+CO, OH-+Al(OH)3===[Al(OH)4]-
19.(原创)实验室为自然科学(化学)兴趣小组的同学准备了四种红色溶液,它们分别可能是KMnO4酸性溶液、滴有酚酞的NaOH溶液、滴有石蕊的稀硫酸和品红溶液。另外还提供了常见的仪器和药品。为了培养同学们的创新精神和实践能力,老师规定只允许选用一种试剂对上述四种溶液加以鉴别。
(1)甲组同学选用了FeCl2溶液,试写出该组同学鉴别出NaOH溶液的有关离子方程式: 。
(2)乙组同学选用了Na2SO3溶液,他们第一步鉴别出来的溶液是AA,对应的现象分别是 。还需继续完成的实验是
(请简要写明操作步骤、现象和结论)。
(3)丙组同学选用了甲、乙两组另外的一种试剂,鉴别时较甲、乙两组在操作上更为简便,你认为他们选择的试剂可能是AA____。
解析:(1)检验Fe2+方法可利用Fe(OH)2的性质(白色絮状沉淀迅速变为灰绿色,最后变为红褐色)。
(3)丙组试剂的选择依据OH-+NHNH3↑+H2O,MnO具有氧化性可将S2-、SO氧化,因而可组成为(NH4)2SO3或NH4HSO3、(NH4)2S、NH4HS。
答案:(1)Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)KMnO4酸性溶液;稀硫酸 红色退去;产生无色刺激性气味气体。(以下答题具有开放性,答案不唯一) 另取未鉴别出的两待测液,分别向其中滴加稀H2SO4,红色退去者为NaOH溶液,剩余为品红溶液。或:另取未鉴别出的两待测液,分别向其中滴加KMnO4酸性溶液,红色退尽者为品红溶液,余者为NaOH溶液。或:另取未鉴别出的两待测液,并以稀H2SO4和Na2SO3反应产生的SO2分别通入到两待测液中,红色退去,取退色溶液加热,重新变红者为品红溶液,余者为NaOH溶液
(3)(NH4)2SO3或NH4HSO3、(NH4)2S、NH4HS
18.现有含杂质的试剂,科学实验中,对物质的纯度有严格的要求,只用一种试剂即可除去下列各物质中的杂质(括号内为杂质),试写出所用试剂及有关反应的离子方程式。
(1)BaCl2(HCl) 选用试剂 ,
离子方程式 。
(2)CO2(SO2) 选用试剂 ,
离子方程式 。
(3)NaCl(Na2SO4) 选用试剂 ,
离子方程式 。
(4)FeCl2(FeCl3) 选用试剂 ,
离子方程式 。
(5)Na2CO3(NaHCO3) 选用试剂 ,
离子方程式 。
解析:根据杂质的性质选择合适的试剂,然后根据离子反应实质进行书写。
答案:(1)BaCO3粉末 BaCO3+2H+===Ba2++CO2↑+H2O (2)饱和NaHCO3溶液 2HCO+SO2===SO+2CO2↑+H2O F的离子方程式为AAAAAAAAAAAA。
aCl2溶液 Ba2++SO===BaSO4↓
(4)铁粉 2Fe3++Fe===3Fe2+ (5)NaOH溶液 HCO+OH-===CO+H2O
17.某无色溶液,其中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、[Al(OH)4]-、S2-、CO、SO、SO。现取该溶液进行有关实验,有如下结果,试回答有关问题
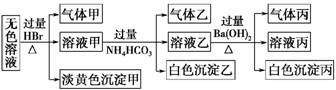
(1)沉淀甲是 ,生成沉淀甲的离子方程式为 。
(2)沉淀乙是 ,由溶液甲生成沉淀乙的离子方程式为 。
(3)沉淀丙是 ,如何用一化学实验来确定其成分? 。
(4)综合上述信息,溶液中可以肯定存在的离子有 。
解析:确定沉淀甲较为关键。若甲是AgBr,即溶液中含Ag+,则所有阴离子均不可能大量存在,转而分析的是S2-、SO与H+反应生成S,从而使思路畅通。
答案:(1)S 2S2-+SO+6H+===3S↓+3H2O
(2)Al(OH)3 Al3++3HCO===Al(OH)3↓+3CO2↑
(3)一定有BaCO3,还可能有BaSO4 向沉淀丙中加入过量的稀盐酸,若沉淀不能完全溶解,说明其中有BaSO4
(4)S2-、SO、[Al(OH)4]-、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com