
题目列表(包括答案和解析)
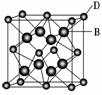
8. 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图。
请回答:
(1)A元素的名称是________________;
(2)B的元素符号是________________,C的元素符号是________________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________________________________________________________________;
(3)E属于元素周期表中第________周期,第________族的元素,其元素名称是________;它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。
解析:依据晶胞结构可知,该晶胞中B与D的个数比为2∶1,再结合题给条件可推出A为H、B为F,C为Cl,D为Ca,E为Mn。
(4)设有1 mol该晶胞。
则有1 mol该晶胞中含有4 mol CaF2,其质量为4×78 g,一个晶胞的体积为:
V=。
答案:(1)氢 (2)F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)四 ⅦB 锰 1s22s22p63s23p63d5 (4)CaF2
7.(2009·江苏单科,21)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________________________________________________________________________。
(2)根据等电子原理,写出CO分子的结构式________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________________________________________________________________________;
甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
③在1个Cu2O晶胞中(结构如下图所示),所包含的Cu原子数目为________。

解析:(1)Zn为30号元素,根据核外电子排布规律即可得出。
(2)根据CO与N2互为等电子体,具有相似结构推断CO的结构式为C≡O(或)。
(3)CH3OH与HCHO均为分子晶体,相对分子质量非常接近,而沸点相差较大,是因为CH3OH分子间存在氢键。形成氢键的条件是①有N、O、F原子,并且N、O、F上存在孤对电子。②有连接在N、O、F上的H原子。根据有机物中碳氧双键为sp2杂化, 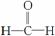 空间构型为平面三角形。甲醛中C-H键均为σ键,碳氧双键中有一个σ键,故有3个σ键。弄清晶胞中位于顶点与体心的空心圆为O,则O原子数=8×+1=2,4个位于体心的黑点为Cu,Cu原子数为4,满足n(Cu)∶n(O)=2∶1。
空间构型为平面三角形。甲醛中C-H键均为σ键,碳氧双键中有一个σ键,故有3个σ键。弄清晶胞中位于顶点与体心的空心圆为O,则O原子数=8×+1=2,4个位于体心的黑点为Cu,Cu原子数为4,满足n(Cu)∶n(O)=2∶1。
答案:(1)1s22s22p63s23p63d104s2或[Ar]3d104s2 (2)C≡O (或
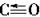 ) (3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4
) (3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③4
6. 某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第______周期,该周期的元素种数是________;
(2)该元素处于元素周期表的第______族,该族的非金属元素种数是________;
(3)根据“相关链接”介绍的知识,该元素处于元素周期表的______区,该区所包括元素族
的种类是____________。
解析:根据元素原子有四个电子层容纳了电子,该元素处于第四周期,该周期元素原子的电子排布式为[Ar]4s1-23d1-104p1-6,故共有18种元素;根据轨道能量顺序和族的相对顺序可以确定该元素位于第ⅢA族,本族元素只有一种非金属元素--硼,根据价电子的电子排布式4s24p1可以确定该元素在p区,由该区元素的价层电子的电子排布式为ns2np1-6,可以确定所包括元素族的种类是ⅢA-ⅦA族、0族。
答案:(1)四 18 (2)ⅢA 1 (3)p ⅢA-ⅦA族、0族
解析:同周期中从左到右,元素的第一电离能(除ⅢA族、ⅥA族反常外)逐渐增大,同周期中金属元素最小,稀有气体最大,故第三周期中第一电离能最小的为Na,最大的为Ar。
答案:(1)Na Ar (2)Cs (3)F (4)N、P、As
5.现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是________。
(2)元素Y与氢元素形成一种离子YH,写出该微粒的电子式____________________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________,理由是________________________________________________________________________。
解析:(1)因T的M层上有2对成对电子,其电子排布式为1s22s22p63s23p4,因此它是硫元素,其最外层有6种不同运动状态的电子,从X的原子结构:“最外层电子数是次外层的电子数的2倍”,且其一种同位素可测定文物年代推知X为碳元素,其同位素符号是C。
(2)因元素Y单质为双原子分子,其氢化物水溶液显碱性推出Y为氮元素,Y与H形成的YH即NH,其电子式为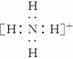 。
。
(3)Z属短周期元素,其最高正价为+7价,则可推知Z为氯元素,它的非金属性比硫强,可以通过b来证实。
(4)从T、X、Y、Z四种元素的最高价氧化物对应水化物来看,分子为H2SO4、H2CO3、HNO3和HClO4,显然H2CO3的性质与其他三种不同,因只有它是非氧化性的酸且是弱酸。
答案: (1)6 C (2)
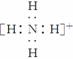 (3)Cl b (4)H2CO3 弱酸性或非氧化性酸
(3)Cl b (4)H2CO3 弱酸性或非氧化性酸
12. (2008·天津理综,26)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________。
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:________________________________________________________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________________________________________________________________。
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:________________________________________________________________________。
解析:本题以元素周期律为依托考查几种常见元素的性质。解题的突破口在第(1)中W、X两种元素最高价氧化物的水化物可以反应生成盐和水,说明W是钠,X是铝。在(2)中W与Y可形成W2Y,说明Y为-2价,应为硫元素,原子序数Y<Z,说明Z为氯元素,元素推出后,其相关的问题就不难作答。
答案:(1)Al(OH)3+OH-===[Al(OH)4]-
(2)Na+[····]2-Na+
(3)酸 Al3++3H2OAl(OH)3+3H+
(4)SO2+Cl2+2H2O===H2SO4+2HCl
(5)HCl H2S (6)S2- Cl- Na+ Al3+
(7)Cl2O7(l)+H2O(l)===2HClO4(aq);ΔH=-4Q kJ·mol-1
11. (2008·广东化学,27)镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有________________。
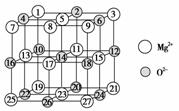
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________________________________________________________。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:________________________________________________________________________。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氟化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1 266 |
1 534 |
183 |
解释表中氟化物熔点差异的原因:________________________________________________________________________。
(5)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
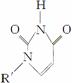 或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
或Cu(Ⅰ)(Ⅰ表示化合价为+1)时,分别形成a和b:
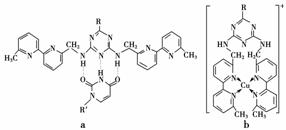
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异________________________________________________________________________
________________________________________________________________________。
解析:(1)Na+、K+、Ca2+氧化性不如Mg2+,不参与放电,只能增强导电性。
(2)因O2-、Mg2+均为10电子微粒,但质子数O2-少于Mg2+,O2-微粒半径较大。
(4)应掌握分子晶体、离子晶体、原子晶体、金属晶体的熔沸点变化规律及影响因素。
答案:(1)增强熔融盐的导电性 (2)空心球应为O2-,实心球应为Mg2+;8号空心球改为实心球
(3)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量 (4)离子晶体微粒间的作用力随阳离子半径的减小、电荷的增大而增大,故MgF2的熔点高于NaF;SiF4是分子晶体,晶体微粒间的作用力为范德华力,因而熔点较低 (5)①σ ②a中存在分子间氢键和范德华力,b中存在配位键
10.(2008·宁夏理综,35)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为________、________;
(2)XZ2与YZ2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是________________________________________________________________________。
(3)Q的元素符号是________,它属于第________周期,它的核外电子排布式为________,在形成化合物时它的最高化合价为________;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键________________。
解析:本题考查题型为物质结构中的元素推断题。考查内容有元素核外电子排布、原子结构、元素含量分布、元素电负性、分子立体结构、分子极性与溶解度的关系,元素化合价和氢键。考查的知识点多,其中,分子空间结构、分子极性与非极性和氢键的内容对学生提出了更高的要求。
(1)X原子核外的M层中只有两对成对电子,其外围电子排布应为3s23p4,可推得该元素为S元素;Y元素原子核外的L层电子数是K层的两倍,K层有2个电子,则L层应有4个电子,该原子核外有6个电子,应为C元素。
(2)地壳内含量最高的元素是氧元素,故Z元素应为氧元素,XZ2是SO2,YZ2是CO2,分子空间结构是由价层电子对互斥模型得出的。
(3)Q的核电荷数是X和Z的核电荷数之和,所以Q的核电荷数为24,应为Cr元素。
(4)E在元素周期表的各元素中电负性最大,应为F元素,它的氢化物为HF。HF在水溶液中形成的氢键可从:HF和HF、H2O和H2O、HF和H2O(HF提供氢)、H2O和HF(H2O提供氢)四个方面来考虑。
答案:(1)S C (2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大 (3)Cr 四 1s22s22p63s23p63d54s1 +6
(4)F-H…F F-H…O O-H…F O-H…O
9. (2009·福建理综,30)Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+的核外电子排布式是________________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小至大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于________(填晶体类型)。
解析:Z原子序数为29,则Z是Cu。Y原子价电子排布为msnmpn,则n为2,Y是ⅣA族短周期元素,用Q、R、X、Y原子序数依次递增,由③知R、Q在第二周期,由④知Q为C,X在ⅥA族,原子序数X<Y,则X为O,Y为Si。R为N。(1)Cu2+核外电子排布式是1s22s22p63s23p63d9。(2)在[Cu(NH3)4]2+中Cu2+的空轨道接受NH3分子提供的孤对电子形成配位键。(3)稳定性是CH4>SiH4,因为C非金属性比Si强;沸点是SiH4>CH4,是因为组成和结构相似的分子,其相对分子质量越大,分子间作用力越强,其沸点越高,故选b。(4)C、N、Si元素中N非金属性最强,其第一电离能数值最大。(5)C的相对分子质量为26的氢化物是C2H2,乙炔分子中碳原子与碳原子间形成了一个σ键和两个π键,碳原子与氢原子间形成两个σ键,则乙炔分子中σ键与π键键数之比是3∶2。
答案:(1)1s22s22p63s23p63d9 (2)孤对电子(孤电子对) (3)b (4)Si<C<N (5)3∶2
(6)原子晶体
8.(2009·安徽理综,25)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第______族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:
Fe(s)+O2(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是________________________________________________________________________。
解析:形成酸雨的主要物质是N和S的氧化物,Y的原子序数比W大,由此可推出W为氮元素,Y为硫元素;根据基态原子核外电子排布所遵循的原则,可以写出X的电子排布式为:1s22s22p63s23p1,X为铝元素;Z能够形成红色Z2O和黑色ZO两种氧化物,推知Z为铜元素。
(1)W是氮元素,同周期元素气态氢化物稳定性从左到右逐渐增强。
(2)S的原子半径比Al的小,更难失电子,第一电离能S的大于Al。
(4)根据盖斯定律,将第二式减去第一式的三倍得3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1。
答案:(1)二 ⅤA 弱 (2)1s22s22p63s23p4 大 (3)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O (4)3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1
7. 三氯化磷分子的空间构型是三角锥型而不是平面正三角形,下列关于三氯化磷分子空间构型的叙述,不正确的是( )
A.PCl3分子中的三个共价键的键长、键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能、键角均相等
D.PCl3是非极性分子
解析:P-Cl键是由不同原子形成的,属于极性共价键,三个P-Cl键相同,键长、键能都相等,三个P-Cl键之间的夹角均为100°,PCl3为三角锥型结构,分子中正电荷重心和负电荷重心不重合,属于极性分子。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com