
题目列表(包括答案和解析)
21.温室效应,又称“花房效应”,是大气保温效应的俗称。大气中的二氧化碳浓度增加,阻止地球热量的散失,使地球上发生可感觉到的气温升高,这就是有名的“温室效应”。
(1)二氧化碳除被绿色植物吸收外,水也是吸收二氧化碳的主力军。CO2溶于水存在的平衡有:______________、____________、____________。
(2)无论是汽水还是啤酒,都充入了一定量的二氧化碳。试解释打开冰镇啤酒瓶把啤酒倒入玻璃杯,杯中立即泛起大量泡沫的原理________________________________________________________________________
________________________________________________________________________。
(3)为了减少CO2的排放,可将CO2进行回收处理,如将CO2与CH4在催化剂作用下发生反应,其反应为:CO2(g)+CH4(g)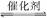 2CO(g)+2H2(g);ΔH>0。在其他条件不变的情况下,达到平衡后将体系体积压缩到原来的1/2,下列有关该体系的说法正确的是______。
2CO(g)+2H2(g);ΔH>0。在其他条件不变的情况下,达到平衡后将体系体积压缩到原来的1/2,下列有关该体系的说法正确的是______。
a.氢气的物质的量浓度减小 b.正反应速率减慢,逆反应速率加快
c.甲烷的物质的量增加 d.重新平衡时n(H2)/n(CH4)减小
解析:(3)当平衡体系的体积压缩至原来的1/2这一瞬间,各组分的物质的量浓度均变为原来的2倍,由于压强增大,平衡逆向移动,但这只减弱了这种改变而不能完全抵消这种改变,故a错;当压强增大时,正、逆反应速率均增大,则b错;平衡逆向移动,甲烷的物质的量增加,氢气的物质的量会减小,则cd正确。
答案:(1)CO2+H2O H2CO3 H2CO3
H2CO3 H2CO3 H++HCO HCO
H++HCO HCO CO+H+
CO+H+
(2)因啤酒中存在溶解平衡CO2(g) CO2(aq),当温度升高,压强减小时,根据勒夏特列原理可知,平衡均逆向移动,故会产生大量的泡沫 (3)cd
CO2(aq),当温度升高,压强减小时,根据勒夏特列原理可知,平衡均逆向移动,故会产生大量的泡沫 (3)cd
20. 将一定量的NaOH与NaHCO3的混合物A,放在密闭容器中加热,充分反应后生成气体V1 L(V1≠0)。将反应后的固体残渣B与过量盐酸反应,又生成CO2 V2 L(气体体积在标准状况下测定),则:
(1)B的成分是( )
A.Na2CO3与NaOH B.Na2CO3与NaHCO3
C.Na2CO3 D.NaOH
(2)A中NaOH与NaHCO3共________摩尔。
NaOH与NaHCO3的物质的量之比为________。
解析:守恒法 因为V1≠0,A受热发生反应后,A中的Na+完全转移成Na2CO3(其物质的量为 mol),则A中的Na+共 mol,即NaOH与NaHCO3共 mol。A中碳元素全部转化为CO2,共 mol。所以A中NaHCO3为 mol。A中NaOH为:-= mol。NaOH与NaHCO3物质的量之比为。
答案:(1)C (2) mol
19.10℃时加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO的水解程度增大,故碱性增强,该反应的离子方程式为_________________________________________________。
乙同学认为溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为________________________________________________________________________。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的BaCl2溶液,若产生沉淀,则乙判断正确。为什么?能不能选用Ba(OH)2溶液?_________________________________________。
(2)将加热后的溶液冷却到10℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言不用再做任何实验也可判断,请你分析谁的观点错误,理由是_______________________________________。
解析:本题为探究性试题,同时考查分析和处理图表的能力。根据甲、乙两同学观点的差异分析知(1)中只能选用BaCl2溶液;由表中数据分析知表中的温度均没有达到150℃,因此可以断定乙同学的猜想是错误的。
答案:HCO+H2O H2CO3+OH- 大于 2NaHCO3Na2CO3+CO2↑+H2O
H2CO3+OH- 大于 2NaHCO3Na2CO3+CO2↑+H2O
(1)若原因是HCO水解程度增大,则溶液中几乎没有CO,所以可用BaCl2溶液检验溶液中是否含有CO来推知乙的观点是否正确,但不能选用Ba(OH)2溶液,因为Ba2++OH-+HCO===BaCO3↓+H2O,若用Ba(OH)2检验,无论哪种观点都会有沉淀产生 (2)等于 甲(或大于
乙) (3)乙的观点是错误的,常压下加热NaHCO3的水溶液,溶液的温度达不到150℃。
18.(1)向纯碱溶液中滴入酚酞溶液,观察到溶液变________色,说明纯碱溶液显______性;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是________________________________________________________________________,
原因是__________________________________________________________。
(2)常温下向饱和Na2CO3溶液中通入足量的CO2观察到的现象是________________________________________________________________________,
原因是__________________________________________________________。
解析:(1)纯碱的成分是Na2CO3,其水溶液显碱性,故滴入酚酞后溶液显红色。若滴加CaCl2溶液,溶液中产生白色沉淀:Na2CO3+CaCl2===CaCO3↓+2NaCl,溶液中呈碱性的Na2CO3转化为中性的NaCl,溶液由红色转变为无色。
(2)向饱和Na2CO3溶液中通入足量的CO2,CO2与Na2CO3溶液发生了反应:Na2CO3+CO2+H2O===2NaHCO3,溶液中的水减少了,溶质的质量比反应前增大了,而NaHCO3的溶解度比Na2CO3的溶解度小得多,所以观察到溶液中有白色固体析出。
答案:(1)红 碱 产生白色沉淀,红色退去 Na2CO3+CaCl2===CaCO3↓+2NaCl,溶液中呈碱性的Na2CO3转化为中性的NaCl,溶液由红色转变为无色 (2)溶液中有白色固体析出 CO2与Na2CO3溶液发生反应:Na2CO3+CO2+H2O===2NaHCO3,溶液中的水减少,溶质的质量比反应前增大,且NaHCO3的溶解度比Na2CO3的溶解度小得多
17. A、B、C、D、E五种物质都含1-18号元素中的某一元素,它们按图所示关系相互转化,已知A为单质。

(1)写出A―→E的化学式:
A.________________________________________________________________________
B.________________________________________________________________________
C.________________________________________________________________________
D.________________________________________________________________________
E.________________________________________________________________________
(2)写出A―→D、C―→D、C―→E反应的化学方程式:
A―→D:____________________________________________________________,
C―→D:____________________________________________________________,
C―→E:____________________________________________________________。
解析:从转化关系图可以看出,单质A与O2反应,在不同条件下可以生成两种不同的氧化物C和B,C和B与水反应生成共同的产物D,D又能与酸性氧化物CO2反应生成E,由此可以确定A是金属Na,B为Na2O,C为Na2O2,D为NaOH,E为Na2CO3,经验证,各物质符合图中转化关系。
答案:(1)Na Na2O Na2O2 NaOH Na2CO3 (2)2Na+2H2O===2NaOH+H2↑ 2Na2O2+2H2O===4NaOH+O2↑ 2Na2O2+2CO2===2Na2CO3+O2
16.通常用NaHCO3溶液除去混在CO2中的少量HCl气体,其离子方程式为________________________________________________________________________,
而不用NaOH溶液的原因(用离子方程式表示)为________________________________________________________________________,
也不用饱和Na2CO3溶液的原因(用离子方程式表示)为________________________________________________________________________。
解析:NaHCO3与CO2不反应,与HCl反应生成CO2气体,离子方程式为:HCO+H+===CO2↑+H2O;NaOH溶液和饱和Na2CO3溶液都能吸收CO2,离子方程式为:CO2+2OH-===CO+H2O;CO+CO2+H2O===2HCO。
答案:HCO+H+===CO2↑+H2O
CO2+2OH-===CO+H2O
CO+CO2+H2O===2HCO
15.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ-Ⅳ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________;
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)________。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)___________________________________________________________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________________________;
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为__________,请设计实验检验所得溶液中溶质的阴离子_____________________________________________________________________。
解析:(1)图Ⅰ不能达到实验目的,因为无论碳酸钠还是碳酸氢钠均可以与盐酸反应产生二氧化碳,二氧化碳气体与澄清石灰水作用变浑浊,故不可以;图Ⅱ可以鉴别,因为等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀程度判断。
(2)图Ⅲ、Ⅳ所涉及的化学方程式为:2NaHCO3Na2CO3+H2O+CO2↑,实验Ⅳ的优点是可同时做对比实验。
(3)试管B装入碳酸氢钠,试管A装入碳酸钠,这样直接加热的碳酸钠,温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
(4)①石灰水过量时,碳酸氢根全部反应,离子方程式为:Ca2++OH-+HCO===CaCO3↓+H2O;②2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,则其中的溶质是碳酸钠,要检验CO,可以取少量上层清液于洁净的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO。
答案:(1)Ⅱ (2)2NaHCO3Na2CO3+H2O+CO2↑ D (3)NaHCO3
(4)①Ca2++OH-+HCO===CaCO3↓+H2O ②Na2CO3 取少量上层清液(或过滤后的滤液或所得溶液)于洁净(若无“洁净”也可)的试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO
14. 将0.5 mol CO2通入200 g 10%的NaOH溶液中,充分反应后,生成盐的类别为( )
A.正盐 B.酸式盐 C.碱式盐 D.不确定
解析:题给CO2与NaOH的物质的量之比为1∶1,反应产物为NaHCO3。
答案:B
13.为了验证碳酸氢钠固体中是否含有碳酸钠。下列实验及判断中,正确的是( )
A.加热,观察是否有气体放出 B.溶于水后加石灰水,看有无沉淀
C.溶于水后加氯化钡溶液,看有无沉淀 D.加热后称量,看质量是否变化
解析:采用加热的方法,只能说明有NaHCO3存在,而不能证明Na2CO3存在;溶于水后与石灰水反应,无论是否含有Na2CO3均有CaCO3沉淀生成;BaCl2与NaHCO3不反应,与Na2CO3反应有BaCO3沉淀生成。
答案:C
12.向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化,如下图所示,各条曲线与溶液中离子数目的大致对应关系相对正确的是( )

A.NS:K+;MP:H+;QR:CO;OT:HCO;RU:Cl-
B.NS:K+;MP:CO;OQR:HCO;OT:Cl-;RU:H+
C.NS:K+;MP:Cl-;QR:H+;OT:HCO;RU:CO
D.NS:K+;MP:H+;OQR:Cl-;OT:CO;RU:HCO
解析:发生反应:CO+H+===HCO
HCO+H+===CO2↑+H2O,然后逐个分析:K+、CO、HCO、Cl-随盐酸加入的变化情况,对号入座即可。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com