
题目列表(包括答案和解析)
16.在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,对氢气的相对密度是________。
答案:1:3 25% 17.5% 4:7 40 20
15.(2009·全国卷Ⅱ)下列叙述中正确的是 ( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1?2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
解析:A项中CaCO3+CO2+H2O===Ca(HCO3)2不是可逆反应;B项:等物质的量的Na2CO3与盐酸反应生成NaHCO3(无CO2生成);C项:应为等物质的量的NaHCO3、Na2CO3分别与足量盐酸反应生成CO2的物质的量相同,D项:因生成的NaHCO3溶解度比Na2CO3小,故会结晶析出。
答案:D
14.(2009·江苏)用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
解析:A项c(OH-)=mol·L-1=0.1 mol·L-1,故1.0 L溶液中n(OH-)=0.1 NA;B项Cl2+2NaOH===NaCl+NaClO+H2O,每1 mol Cl2参与反应电子转移数目为1 mol,故B项中电子转移数目为0.1 NA;D项中CH3OH在标准状况下不是气态物质。
答案:C
13.(2009·福建)设NA为阿伏加德罗常数,下列叙述正确的是 ( )
A.24 g镁原子的最外层电子数为NA
B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1 NA
C.1 mol甲烷分子所含质子数为10NA
D.标准状况下,22.4 L乙醇的分子数为NA
解析:A中Mg: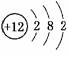 ,故24 g镁即1
mol镁最外层有2NA电子。
,故24 g镁即1
mol镁最外层有2NA电子。
B中:乙酸为弱酸,部分电离,故最终H+数远小于0.1NA。
C中:1个CH4分子中含10个质子,故C项正确。
D中:标准状况下,乙醇为液体,不能使用气体摩尔体积。
答案:C
12.(2009·广东)设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是 ( )
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 nA个Fe3+
解析:乙烯和环丙烷的最简式(实验式)均为CH2,故28 g两者的混合物含4 nA个氢原子;FeCl3溶于水后因Fe3++3H2OFe(OH)3+3H+,0.1 mol FeCl3溶于水后,所得溶液中Fe3+小于0.1 nA个。
答案:C
11.(2009·天津二模5月)下列说法正确的是 ( )
①标准状况下,22.4 L己烯含有的分子数为6.02×1023
②标准状况下,a L的氧气和氮气和混合物含有的分子数约为×6.02×1023 ③7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023 ④60 g SiO2晶体中含有2×6.02×1023个Si-O键 ⑤1 mol乙醇中含有的共价键数约为7×6.02×1023 ⑥500 mL 1 mol·L-1的硫酸铝溶液中含有的硫酸根离子数约为1.5×6.02×1023
A.①④ B.②⑥
C.③⑤ D.②⑤
解析:①标准状况下己烯为液体;③7.1 g Cl2为0.1
mol,与NaOH反应时只有全部变为Cl-时,转移电子数才为0.2×6.02×1023,而Cl2与NaOH反应时不可能全部变为Cl-;④60 g SiO2中应有Si-O键4×6.02×1023个,因为一个Si原子可形成4个Si-O键;⑤乙醇的结构式为 ,应含有8×6.02×1023个共价键。②⑥正确。
,应含有8×6.02×1023个共价键。②⑥正确。
答案:B
0.1 mol 0.36 mol
由于盐酸变稀而使反应停止;B中铝会钝化;D中CO2相对于Ba(OH)2少量。
答案:C
10.在给定条件下,下列下划线所示的物质在化学反应中能被完全消耗的是( )
A.用30 mL 12 mol/L浓盐酸与8.7 g二氧化锰共热制取氯气
B.标准状况下,将2.7 g铝片投入到20 mL 18 mol/L的硫酸中
C.向100 mL 3 mol/L的盐酸中加入5.6 g铁
D.向含Ba(OH)2和NaOH各0.1 mol的混合溶液中通入标准状况下2.8 L CO2气体
解析:A中由
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
1 4
9.某氯原子的质量为a g,12C原子的质量为b g。用NA表示阿伏加德罗常数。下列说法中不正确的是 ( )
A.则该氯原子构成氯分子的相对分子质量为
B.m g该氯原子的物质的量为mol
C.n g该氯原子所含的电子数为
D.1 mol该氯原子的质量为aNA g
解析:A项不正确,由相对原子质量定义知:=为氯原子的相对原子质量,氯分子的相对分子质量应为;B项正确,一个氯原子质量为a g,故1 mol氯原子质量为aNA g,则m g该氯原子物质的量为 mol;C不正确,n g氯原子的电子数应为×17NA=;D正确。
答案:AC
8.已知Q与R的摩尔质量之比为9?22,在反应X+2Y===2Q+R中,当1.6 g X与Y完全反应后,生成4.4 g R,则参加反应的Y和生成物Q的质量之比为 ( )
A.46:9 B.32:9
C.23:9 D.16:9
解析:已知Q与R的摩尔质量之比为9?22,结合方程式可以知道,反应生成的Q和R的质量比为18?22,也就是,1.6 g X与Y完全反应后,生成了4.4 g R,同时生成了4.4 g×=3.6 g Q,消耗Y的质量为3.6 g+4.4 g-1.6 g=6.4 g。所以,参加反应的Y和生成物Q的质量之比为:6.4 g?3.6 g=16:9。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com