
题目列表(包括答案和解析)
17.某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图。
②在电流强度为IA,通电时间为t s后,精确测得其电极上析出的铜的质量为m g。

试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示,下同):
E接________,C接________,________接F。
实验线路中的电流方向为________―→________―→________―→C―→________―→________。
(2)写出B极上发生反应的电极反应式:________________,G试管中淀粉KI溶液变化的现象为________________,相应的离子方程式是________________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是________。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜,后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算表达式:NA=________。
解析:(1)首先应确定电极A、B的极性,因B极上有气体吸收装置G与之相连,所以B应为阳极,与电池正极相连;A为阴极,与电池负极相连。再在A、E之间串联上电流计即可。
(2)B极上Cl-被氧化,生成的Cl2使试管G中的淀粉KI溶液变蓝。
(3)电解生成的Cu附着在电极上是无法将其恰好完全刮下称量的,所以应比较电解前后的质量之差。
(4)由电荷守恒关系式:It=×2NA×1.6×10-19。故NA=×。
答案:(1)D A B;F B A D E (2)2Cl--2e-―→Cl2↑ 变蓝色
Cl2+2I-―→2Cl-+I2 (3)①③④⑥ (4)×
15.依据氧化还原反应:
2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是____________;
(2)银电极为电池的______________极,发生的电极反应为________________;X电极上发生的电极反应为________________________________________________________________________;
(3)外电路中的电子是从________电极流向________电极。
思路点拨:正确理解和运用原电池原理,抓住反应特征,结合装置图确定电极名称和电极反应,进而确定电解质和电子的流向。
解析:(1)根据所给的氧化还原反应,Cu(s)在反应中变成Cu2+被氧化,电极X为原电池的负极,发生氧化反应,所以电极X的材料是Cu。电解液Y应能提供Ag+,故为AgNO3溶液。
(2)银电极上发生了还原反应,故为原电池的正极,电极反应为Ag++e-―→Ag。X电极上发生氧化反应,电极反应为:Cu―→Cu2++2e-。
(3)外电路中的电子从负极流向正极,即从铜电极流向银电极。
答案:(1)铜 AgNO3溶液 (2)正 Ag++e-―→Ag Cu―→Cu2++2e- (3)铜 银
16 将铜棒与锌棒用导线连接,依次插入分别盛有:①硫酸溶液;②硫酸铜溶液;③硫酸钠溶液的三个烧杯中,此时,
(1)铜片上发生的主要反应的电极反应式是:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(2)铜制品在经常下酸雨的地区电化学腐蚀严重,写出此电化学腐蚀的电极反应式:
正极________________________________________________________________________;
负极________________________________________________________________________。
(3)将表面去掉氧化膜的镁片与铝片用带电流表的导线连接,插入盛有烧碱溶液的烧杯中,此时发现电流计指针偏转,判断此原电池的正负极,并写出电极反应式和总反应方程式。
正极:________,电极反应式:________________________________________________________________________,
负极:________,电极反应式:________________________________________________________________________,
总反应:________________________________________________________________________。
答案:(1)①2H++2e-―→H2↑ ②Cu2++2e-―→Cu ③O2+2H2O+4e-―→4OH-
(2)O2+2H2O+4e-―→4OH- Cu-2e-―→Cu2+ (3)Mg 2H++2e-―→H2↑ Al
Al+4OH--3e-―→[Al(OH)4]- 2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
14. (2009·海南单科,15)LiSOCl2电池可用于心脏起博器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为________________,发生的电极反应为________________;
(2)电池正极发生的电极反应为________________________________________________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是________________,反应的化学方程式为________________。
(4)组装该电池必须在无水、无氧的条件下进行,原因是________________。
解析:(1)、(2)电池负极发生氧化反应,正极发生还原反应。(3)由NaOH与SOCl2反应的产物为Na2SO3、NaCl可知,SOCl2与水反应生成H2SO3和HCl。(4)由于电池材料易与水、O2反应。
答案:(1)锂 Li-e-―→Li+
(2)2SOCl2+4e-―→4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O===2HCl↑+SO2↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
13.近年来,有科学家在研究利用发电厂产生的SO2制成原电池,其电池反应方程式为:
2SO2+O2+2H2O===2H2SO4,该电池电动势为1.06 V。
(1)写出电极反应:负极反应式为:________________;正极反应式为:________________。
(2)使用这种方法处理发电厂废气中SO2的优点是________________。
解析:根据原电池反应原理,负极上发生氧化反应,正极上发生还原反应。SO2跟O2反应生成H2SO4时,SO2被氧化、O2被还原,所以SO2应该在负极上反应,O2应该在正极上反应。
答案:(1)SO2+2H2O-2e-―→SO+4H+;O2+4H++4e-―→2H2O
(2)从环保的角度看,利用上述电池,可以在回收二氧化硫的同时得到副产品H2SO4,减少环境污染,又能在回收过程中获得电能,一举多得
12.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
解析:甲池中锌与铜用导线连接后浸入稀H2SO4中,形成原电池,乙池中仅发生锌与H2SO4的反应。所以甲池中铜片表面有气泡产生,乙池不构成原电池,两池中c(H+)均减小,甲池中产生气泡的速率比乙快。
答案:C
11.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )

解析:A项是将电能转化成化学能;B项是将水的势能转化成电能;C项是将太阳能转化成热能。
答案:D
10.有关下图装置叙述正确的是( )

A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+4e-+2H2O―→4OH-
D.Fe为阳极,电极反应为:2Fe-4e-+4OH-―→2Fe(OH)2
解析:该装置没有外接电源,故不是电解装置,A错;对于B项,因为向NaOH(aq)不断通入空气,故Fe(OH)2生成后立即被氧化成Fe(OH)3;D项中Fe是负极,发生氧化反应,也可称阳极。
答案:CD
9. 在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是( )
A.电子从原电池的负极通过导线移向正极 B.电子从原电池的正极通过导线移向负极
C.阴离子在电解质溶液中向正极移动 D.阳离子在电解质溶液中向正极移动
解析:根据同一闭合回路中,同性电荷运动方向一致,异性电荷运动方向相反的规律,在电解质溶液中阴离子向负极移动,阳离子向正极移动。
答案:AD
8.用锌粒和盐酸制氢气时,加入少量下列试剂,可使生成氢气的速率加快的是( )
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
解析:锌与硫酸铜溶液反应生成铜,铜与锌在酸溶液中构成原电池,加速锌失去电子;加水,盐酸浓度降低,反应速率减小,B错;加入氯化钡晶体,无影响,C错;加入醋酸钾,盐酸与其反应生成弱酸醋酸,反应速率减小,D错。
答案:A
7.将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )
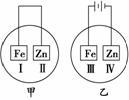
A.Ⅰ和Ⅱ B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
解析:甲为原电池装置,Zn为负极,该条件下,Zn被腐蚀,电极反应为负极:
Zn-2e-―→Zn2+,正极:2H2O+O2+4e-―→4OH-,故Ⅰ电极c(OH-)增大使酚酞变红。乙为电解装置,电极反应为:阳极Fe-2e-―→Fe2+,阴极2H++2e-―→H2↑,Ⅳ极区域c(OH)-增大,使酚酞变红。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com