
题目列表(包括答案和解析)
6.(2010·模拟题)下列关于热化学方程式的描述中正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l);
ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1,则CH3OH的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g);ΔH=+571.6 kJ·mol-1
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则1/2 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
解析:A项中未指明n(H2SO4)和n[(Ba(OH)2)]是多少,况且Ba2++SO42-===BaSO4也放出热量;B项中H元素未转化为稳定的氧化物[H2O(l)];C项中H2O应为液态。
答案:D
5.(2009·重庆,12)下列热化学方程式书写正确的是(ΔH的绝对值均正确)
( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-1 367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+57.3 kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);ΔH=-296.8 kJ/mol(反应热)
D.2NO2===O2+2NO;ΔH=+116.2 kJ/mol(反应热)
解析:选项A,H2O呈气态时不稳定,不是表示燃烧热的热化学方程式;选项B,中和反应为放热反应,ΔH<0,ΔH=-57.3 kJ/mol,B错误;选项C,S燃烧生成SO2的反应是放热反应,ΔH<0,同时表明了物质的聚集状态等,C正确;选项D,未注明物质的聚集状态,D错误。
答案:C
4.(2010·河北常德一中月考)下列实验装置图正确的是( )
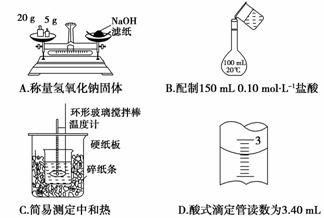
解析:A中砝码与药品的位置放错,NaOH不宜用滤纸来称量;B中应该用玻璃棒引流,且容量瓶规格选错;C中大小烧杯上口应齐平;D是滴定管,数值是上小下大。
答案:D
3.(2010·改编题)已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时要放出431 kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+
Cl2(g)===2HCl(g)
B.氢气与氯气反应生成2 mol氯化氢气体,反应吸收183 kJ的热量
C.氢气与氯气反应生成1 mol氯化氢气体,反应放出183 kJ的热量
D.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的热量
解析:由题给已知条件,可写出热化学方程式:H2(g)+Cl2(g)===2HCl(g);ΔH=436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol;A项中未写出ΔH;B项中应是放出183 kJ的热量;C项中应是放出91.5 kJ的热量。
答案:D
2.(2010·湖北众望高中月考)下列关于热化学反应的描述中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
|

 C.N2(g)+3H2(g)
2NH3(g);ΔH<0,说明N-H键能总和小于N≡N与H-H键能总和
C.N2(g)+3H2(g)
2NH3(g);ΔH<0,说明N-H键能总和小于N≡N与H-H键能总和
D.稀溶液中:H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含0.5 mol Ba(OH)2的稀溶液混合,放出的热量等于57.3 kJ
解析:硫由气态变为固态会放出热量,因此等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多;N2(g)+3H2(g)催化剂高温、高压2NH3(g);ΔH<0,说明反应放热,6 mol N-H键能总和大于1 mol N≡N与3 mol H-H键能总和;稀硫酸与Ba(OH)2的稀溶液反应的离子方程式为:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O,虽然生成1 mol H1O(l),但反应的热效应与沉淀有关,故其放出的热量不等于57.3 kJ。
答案:B
1.科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示。下列说法错误的是( )
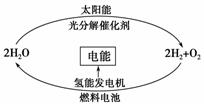
A.在氢能的利用过程中,H2O可循环使用
B.氢气、氧气和稀硫酸构成的燃料电池中,正极的电极反应为:
O2+4e-+2H2O===4OH-
C.该法制氢的关键是寻找光分解催化剂
D.利用光电转化可将太阳能转化为电能用于电解水而获得氢气
解析:选项A,H2O分解产生H2和O2,H2和O2在一定条件下反应释放能量同时又生成H2O;选项B,在酸性环境中正极的电极反应为:O2+4e-+4H+===2H2O;选项C,由图可知,寻找合适的光分解催化剂,可使水的分解速率加快;选项D,利用光电效应产生的电流电解水获得H2。
答案:B
15.(2010×天津八校期中联考题)已知元素的电负性和原子半径一样,也是元素的一种基本性
质。短周期元素的电负性数值表。
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
0.8 |
请仔细观察表格中的数据,回答下列有关问题:
(1)根据表中的数据,可推测元素的电负性具有的变化规律是
________________________________________________________________________。
(2)由表中数据可得出同主族元素的电负性变化规律是
________________________________________________________________________。
(3)由表中数据预测电负性最大的元素为________;电负性较大与电负性较小的两元素之间
易形成的化学键类型是________。
解析:(1)根据所提供的主族元素的电负性数据及“元素的电负性和原子半径一样”可推出
元素的电负性随着原子序数的递增呈现周期性变化;(2)同主族元素的电负性随着原子序数
的增加而减小;(3)电负性越大的元素的非金属性越强,电负性越小的元素的金属性越强,
则两者易通过离子键形成离子化合物。
答案:(1)随着原子序数递增呈周期性变化 (2)从上到下逐渐减小 (3)F 离子键
14.(2010×模拟题)(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2,
其中由非极性键形成的非极性分子是________;由极性键形成的非极性分子是________;
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元
素形成的离子化合物,其电子式为:____________;若XY2为共价化合物时,其结构式为:
__________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02´103 Pa),但在180℃就开
始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明
你的判断正确的实验依据是
________________________________________________________________________。
(4)现有a-g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
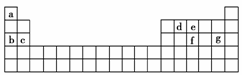
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的
是________;
A.c和f B.b和g C.d和g D.b和e
②写出a-g7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
_______________________________________________________________________。
解析:(2)1∶2型离子化合物,通常X为+2价Y为-1价,故X可能是Mg2+或Ca2+,Y可能
是F-或Cl-,结合XY2中含有38个电子条件可推出XY2为CaF2,1∶2型共价化合物则为CS2。
答案:(1)①②⑩ ⑥⑦ ④ ③⑤
(2) 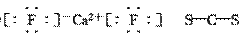
(3)共价化合物 氯化铝在熔融状态下不能导电
(4)①B C ②CCl4或CO2
13.(2010×山西师大附中期中考题)A、B、C、D、E、为主族元素。A、B、C同周期且原子半
径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素
的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生
成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元
素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元
素。试回答下列问题:
(1)C元素离子的结构示意图是____________。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是________(填化学
式),B的10电子氢化物的分子空间构型为________。
(3)B与E可形成离子化合物BE5,BE5的电子式是____________,含有的化学键类型有
________。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离子化合
物结构是________(填字母标号a或b)。
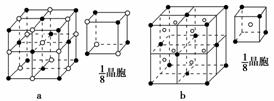
解析:根据题意可推出A、B、C、D、E五元素分别是C、N、F、Ca、H。(4)a结构表示的
是阴、阳离子1∶1构成的离子晶体,而b结构表示的是阴、阳离子2∶1构成的离子晶体。
C与D形成的化合物(CaF2)中阴、阳离子的个数比恰好为2∶1,所以结构应是b。
答案:(1) 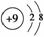 (2)NH3 三角锥型 (3)
(2)NH3 三角锥型 (3) 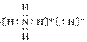 共价键、离子键
共价键、离子键
(4)b
12.(2010×改编题)下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电
的良导体。
|
单质 |
a |
b |
c |
d |
e |
|
沸点(℃) |
58.8 |
882.9 |
444.7 |
2
355 |
1
107 |
(1)a呈________色,a的元素在元素周期表中的位置为________。
(2)写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类
型),溶于强碱的离子方程式为
________________________________________________________________________。
(3)c与氢形成的分子X的空间构型为________;写出X的水溶液与b的元素的最高价氧化
物对应水化物反应的离子方程式
________________________________________________________________________。
(4)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对
应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为
________。
(5)写出b元素与氯元素形成的化合物Y的电子式________,Y晶体中,1个晶胞内含有的
基本微粒及个数是________。
解析:首先确定最高沸点对应的物质d是Si,最低的a为Br2;由b和e是热和电的良导体
,那么b为Na、e为Mg、c为S。其次代入(1)-(6)问题逐一分析(1)Br2是深棕红色液体;(2)SiO2
为原子晶体,可与强碱反应;(3)H2S为V型分子;(4)Mg2+半径最小,Mg3N2是离子化合物;
(5)NaCl晶胞中含有4个Na+和4个Cl-。
答案:(1)深棕红 第四周期ⅦA族 (2) 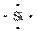 原子 SiO2+2OH-===SiO
原子 SiO2+2OH-===SiO +H2O
+H2O
(3)V型 H2S+OH-===H2O+HS-或H2S+2OH-===2H2O+S2-
(4)Mg2+ H2SO4 Mg2+[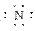 ]3-Mg2+[
]3-Mg2+[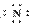 ]3-Mg2+
]3-Mg2+
(5)Na+[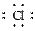 ]- Na:4个 Cl-:4个
]- Na:4个 Cl-:4个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com