
题目列表(包括答案和解析)
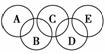
13.(2009×海滨区5月考题)右图所示五元环代表A、B、C、D、E五种化合物,圆圈交
叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化
合物仅含有两种元素。A是沼气的主要成分;B、E分子中所含电子数都为18,B不
稳定,具有较强的氧化性,E是由六个原子构成的分子,C是工业制玻璃的主要原料
之一;D中所含的两种元素的原子个数之比为3∶4。根据以上信息推测A、B、C、
D、E的化学式:A.________,B.________,C.________,D.________,E.________。
解析:本题考查元素的推断。A是沼气的主要成分,为CH4,C是工业制玻璃的主要
原料之一,是SiO2,B不稳定,具有较强的氧化性,具有18个电子,根据A和C两
物质中含有相同的元素,可以猜测为H2O2,D中所含的两种元素的原子个数之比为
3∶4,若D中有Si元素,则为Si3N4,所以E中有氮元素,E是由六个原子构成的
分子,且有18电子,可知为N2H4。
答案:CH4 H2O2 SiO2 Si3N4 N2H4
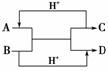
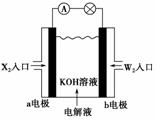
12.(2010×石家庄实验中学月考题)有X、Y、Z、W四种短周期元素,原子序数依次增大。
X的阳离子就是一个质子。Z、W在周期表内处于相邻位置,它们的单质在通常状况
下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为________,Y的原子结构示意图为________。
(2)将X2、W2按如上图所示通入某燃料电池中,其中,b电极为______极(填“正”或
“负”),电极反应式为
_______________________________________________________________________。
(3)X、Y两种元素组成一种气体,在标准状况下密度为1.25 g×L-1,实验室制取该气
体的化学方程式为:
_______________________________________________________________________。
(4)由X、Y、Z、W四种元素组成的酸式盐,与足量的NaOH溶液在加热条件下反应
的离子方程式为:
_______________________________________________________________________。
解析:(1)根据核外电子排布规律以及周期表的知识,推知X为H,Y为C,Z为N,
W为O。
(2)氢氧燃料电池中,通H2的电极为负极,通O2的电极为正极,因此b电极为正极,
电极反应式为O2+4e-+2H2O===4OH-。
(3)X、Y两种元素组成的气体为气态烃,其相对分子质量为Mr=1.25´22.4=28,所以
该气体为C2H4,实验室制乙烯的化学方程式为
CH3CH2OH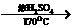 CH2===CH2↑+H2O。
CH2===CH2↑+H2O。
(4)H、C、N、O四种元素组成的酸式盐为NH4HCO3,与NaOH在加热条件下反应的
离子方程式为NH4++HCO3-+2OH- NH3↑+CO
NH3↑+CO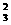 -+2H2O。
-+2H2O。
答案: (1) 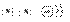
(2)正 O2+2H2O+4e-===4OH-
(3)C2H5OH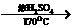 CH2===CH2↑+H2O
CH2===CH2↑+H2O
(4)NH4++HCO3-+2OH- NH3↑+2H2O+CO
NH3↑+2H2O+CO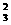 -
-
11.(2010×山师附中第二次月考题)A-D是原子序数在20以内的元素,其性质或结构信
息如下表
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
其单质和化合物的焰色均为黄色 |
其氢化物的水溶液能腐蚀玻璃 |
湿润的红色石蕊试纸遇其最低价氢化物变蓝 |
其原子核外有13种运动状态的电子 |
请根据表中的信息回答下列问题:
(1)A元素简单离子的结构示意图________;D元素原子的电子式________,C元素
简单离子的电子式________。
(2)和B的氢化物所含电子数相同的4种粒子有________________。
(3)C的单质特别稳定,原因在于
_______________________________________________________________________。
C的气态氢化物的水溶液中存在的平衡:
_______________________________________________________________________。
(4)工业上制取D的单质的化学方程式为
_______________________________________________________________________。
解析:由性质或结构信息入手分析:焰色为黄色只有钠元素;氢化物中只有HF腐蚀
玻璃;NH3是唯一(中学化学中)能使湿润红色石蕊试纸变蓝的气体;有13种运动状
态的电子就是核外有13个电子,即Al。所以A、B、C、D依次为Na、F、N、Al。
答案:(1) 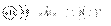
(2)Ne、H2O、NH3、CH4、OH-、F-、O2-、N3-、Na+、Mg2+、Al3+、H3O+、NH4+
(3)N2分子中存在N N,键能大,很稳定 NH3+H2O
N,键能大,很稳定 NH3+H2O NH3×H2O
NH3×H2O
NH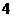 +OH-
+OH-
 (4)2Al2O3(熔融) 4Al+3O2↑
(4)2Al2O3(熔融) 4Al+3O2↑
10.(2010×改编题)硼有两种天然同位素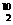 B、
B、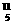 B,硼元素的近似相对原子质量为10.80,
B,硼元素的近似相对原子质量为10.80,
则对硼元素中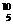 B的质量分数判断正确的是( )
B的质量分数判断正确的是( )
A.20% B.略大于20% C.略小于20% D.80%
解析:由B的近似相对原子质量,结合十字交叉法可得出: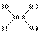 =
=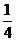 ,可
,可
见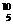 B原子个数百分数为20%,而每一个
B原子个数百分数为20%,而每一个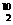 B质量小于
B质量小于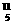 B的质量,所以
B的质量,所以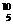 B的质量
B的质量
分数小于20%。
答案: C
9.(2010×模拟题)美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3
个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是( )
A.是氢元素的一种新的同素异形体 B.是氢元素的一种新的同位素
C.该微粒的组成可用H3表示 D.该微粒比普通氢分子多一个氢原子核
解析: 该新的氢微粒的符号为:H3+,它是一种离子,不是单质,因而不是同素异
形体;也不是原子,因而也不是同位素;此微粒可以看成由氢气分子结合了一个氢离
子而形成,因而D正确。
答案:D
8.(2010×模拟题)已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,
则下列叙述正确的是( )
A.原子半径 A>B>D>C B.原子序数 a>b>d>c
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
解析:具有相同的电子层结构,说明核外电子排布相同,核外电子数相同,即
a-2=b-1=c+3=d+1,可见B项正确,其原子半径大小应是B>A>C>D,离子半径大小
应是C>D>B>A,可见A错,C正确;单质A、B具有还原性且强弱是B>A。
答案:BC
7.(2010×青岛二中期中考题)下面有关14C、15N叙述正确的是( )
A.14C与15N有相同的中子数 B.14C与C60互为同素异形体
C.14N与15N互为同素异形体 D.14C的核外电子数与中子数相同
解析:A项,14C与15N的中子数均为8;B项,14C是一种原子,C60为C元素的一
种单质,只有是同种元素的不同单质才互为同素异形体,所以B、C两项均不正确;
D项,14C质子数为6、中子数为8。
答案:A
6.(2010×模拟题)“神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT。其中Li的
质量数为7,对这三种物质的下列说法正确的是( )
A.质子数之比为1∶2∶3 B.中子数之比为1∶1∶1
C.摩尔质量之比为8∶9∶10 D.化学性质不相同
解析:A项,质子数之比为(3+1)∶(3+1)∶(3+1)=1∶1∶1;B项,中子数之比为
(4+0)∶(4+1)∶(4+2)=4∶5∶6;C项摩尔质量之比为:(7+1)∶(7+2)∶(7+3)=8∶9∶10;
D项,三种物质的化学性质相同。
答案:C
5.(2010×改编题)下列有关核素的说法正确的是 ( )
A.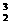 He可代表一种核素 B.同种元素只可形成一种核素
He可代表一种核素 B.同种元素只可形成一种核素
C.不同核素的质量数一定不等 D.核素就是元素的别称
解析:A项,正确;B项,同种元素可形成不同的核素,如氢元素可形成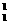 H、
H、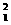 H、
H、
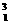 H三种核素;C项,不正确,如
H三种核素;C项,不正确,如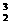 He与
He与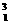 H的质量数相等;D项,核素是指具有一
H的质量数相等;D项,核素是指具有一
定数目的质子和一定数目的中子的一种原子,不能等同于元素。
答案:A
4.(2010×模拟题)X、Y、Z为短周期元素,原子序数依次增大。X原子的最外层电子数
是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族。下列叙述不
正确的是 ( )
A.原子半径:Y>Z
B.X元素的一种单质可用于消毒杀菌
C.Y的氧化物是工业制取Y单质的主要原料
D.Z的单质在氧气中点燃可生成两种酸性氧化物
解析:由X与Y原子结构间的关系、采用有序假设法进行分析。假设Y原子最外层
电子数为1,Y为H、Li、Na,那么X为Be、Mg,不合题意,假设Y为Be、Mg,
则X为C、Si,不合题意;假设Y为B、Al,则X为O,符合题意。由此推出Z为
S,Y为Al代入选项得出D项符合题意。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com