
题目列表(包括答案和解析)
1. 0.03mol铜完全溶与硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是( )
A.30 B.46 C.50 D.66
思维方法: 。
展望高考:
6.磷
(1)了解白磷分子结构,并与NH4+、CH4的空间结构、键角做对比。
(1)白磷是一种 色 状固体,有剧毒, 溶与水, 溶与CS2, 着火点为 。 白磷通常保存 里。红磷是 粉末状固体, 毒, 溶与水, 溶与CS2,
着火点为 。两者互为 。
(2) P + O 2 → P + Cl2(足量) →
(3) P2O5是 的酸酐,是 固体,有极强的 性,是一种酸性干燥剂。P2O5不能干燥 等 性气体。
[例题解析]
[例1]常温下,在V L密闭容器中有a mol NO气体,压强为b kpa,若再充入a mol O2,保持温度不变,反应后容器内的压强是 ( )
A.等于1.5b kpa B. 等于2b kpa
C. 小于1.5b kpa D. 大于1.5b kpa
解题思路: 。
易错点: 。
[例2] A、B、C、D、E五种含氧化合物,(除氧元素外)还有一种元素X相同,它们之间 转化关系如下:a.A+O2→B b. B + H2O→ A + C c. A + B + H2O→D d. 2B→E ( a、 b、c均未配平)回答下列问题:
(1) 元素X的符号是
(2)写出b反应的化学方程式 。
(3)写出c反应的化学方程式 。
解题思路: 。
易错点: 。
[考题再现]
5.有关NO、NO2、O2等与水的作用计算(无气体剩余的比例)
4NO2 ~ O2 4NO ~ 3O2 NO2 ~ NO ~ O2
4.NO2的性质
(1) 红棕色有毒、有刺激性气味的气体。
(2) 3NO2 + H2O = 2HNO3 + NO 2NO2 = N2O4 (在解化学题中有很重要的应用) NO2+SO2=SO3+NO
3.NO的性质
(1) 无色有毒、不溶与水的气体,能与血红蛋白作用。
(2) 2NO + O2 =2 NO2 NO + NO2 + 2NaOH = 2NaOH + H2O (除硝酸厂的尾气)
不与碱作用生成盐,为不成盐氧化物。
2. N2的化学性质
N2 + H2 → N2 + O2 →
N2+Mg→ Mg3N2+H2O→
1.N2的电子式 ,结构式 。由此可以得出 N2分子的结构很 ,化学性质 活泼。
15.(2010·改编题)右图中的A-H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、C、G都含有同一种元素,B、E、F均为单质。常温、常压下,D为液体,E、F为气体。C由两种元素组成,其晶体的熔点很高,硬度很大,且有着晶莹的光泽。A-H有可能发生如下的转化,其反应关系如图所示:
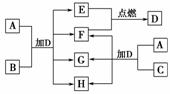
请填写下列空白:
(1)写出E+F―→D的化学反应方程式_________________________________________。
(2)A的电子式为________,H的化学式为________。
(3)如框图所示,A与C两种固体混合后,加入液体D发生反应的化学方程式为________________________________________________________________________。
解析:短周期元素中,单质在常温常压下为气体的只有五种,(0族除外)它们分别是H2、N2、O2、F2、Cl2,即E、F是以上五种气体中的各一种,考虑到E、F混合点燃后生成常温常压下为液体的D,可以肯定D是H2O,而E、F是H2或O2。那么现在的问题是什么样的?单质B与化合物A的混合物在加水后既可以生成H2,又可以生成O2,则A只能是Na2O2,而B为铝或硅,发生的反应如下:
2Na2O2+2H2O===4NaOH+O2↑①
2Al+2NaOH+2H2O===2NaAlO2+3H2↑②
(或Si+2NaOH+H2O===Na2SiO3+2H2↑)
当2n(Na2O2)>n(Al)时,以上反应相加可得四种产物,即H2、O2、NaAlO2、NaOH。[或当n(Na2O2)>n(Si)时,以上反应相加有可能得四种产物,即H2、O2、Na2SiO3、NaOH。]
考虑到题知B、C、G中均含有同一种元素,显然G为NaAlO2(或Na2SiO3),C为Al2O3(或SiO2),而Al2O3或SiO2正好是由两种元素组成的具有很高熔点和很大硬度的有晶莹光泽的原子晶体,与题给条件相吻合。
答案:(1)2H2+O22H2O (2)Na+[········??··]2-Na+ NaOH
(3)2Na2O2+2H2O===4NaOH+O2↑;Al2O3+2NaOH===2NaAlO2+H2O(或SiO2+2NaOH===Na2SiO3+H2O)。
14.(2010·长沙一中期中考题)食盐是日常生活的必需品,也是重要的化工原料。
 (1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%的乙醇溶液 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有_____________________________________________ (填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是__________________________。
 装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为____________。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4===ZnSO4+H2↑,MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:

解析:(1)①除去Ca2+、Mg2+、Fe3+、SO42-,但不带入新的杂质,不能用K2CO3、Ba(NO3)2溶液,用BaCl2除去SO42-,NaOH除去Mg2+、Fe3+,再用Na2CO3除去Ca2+和过量的Ba2+。②为减少NaCl的溶解,可选用75%的乙醇溶液。
答案:(1)①BaCl2、NaOH、Na2CO3(其他合理答案也可以) ②75%的乙醇溶液
(2)天平、烧杯、500 mL容量瓶、胶头滴管
(3)< Cl2在水中的溶解度较H2大,电解生成的Cl2可能与电解生成的NaOH发生了反应 酸碱中和滴定
(4)e d
13.(2010·邗江中学期中考题)某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可以和SO2反应,反应式可能为:2Na2O2+2SO2===2Na2SO3+O2,为此设计如下一套装置来验证Na2O2和SO2的反应产物。

如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸。完成下列问题。
(1)点燃①处酒精灯不久,观察到①处产生大量气体,③处硬质玻璃管的管壁发热,管内药品的颜色变化为由________色逐渐变为________色。
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
________________________________________________________________________。
(3)⑥处用排水法收集的气体,从什么现象可证明收集的气体中已不含SO2?
________________________________________________________________________。
(4)待反应结束后,取硬质玻璃管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
________________________________________________________________________。
(5)待反应结束后,取硬质玻璃管内少量固体,装入试管中,加入足量盐酸溶液,无气体放出,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因________________________________________________________________________
________________________________________________________________________。
解析:Na2O2为淡黄色固体,反应后生成的Na2SO3、Na2SO4都为白色固体。检验O2的方法是用带有火星的木条;检验SO2的方法是用品红溶液;检验SO32-的方法通常为加盐酸,看生成气体的性质;检验SO42-的方法是用Ba2+,但要注意排除某些离子的干扰。
答案:(1)淡黄 白
(2)找开⑥处瓶塞,用带火星的木条置于⑥中水面的上方,若木条复燃,则证明反应产生了O2
(3)⑤中品红溶液的红色不褪去
(4)加入盐酸,若有刺激性气味的无色气体逸出,则证明产物中含有Na2SO3
(5)Na2O2+SO2===Na2SO4,Na2SO4+BaCl2===BaSO4↓+2NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com