
题目列表(包括答案和解析)
5.向某晶体的水溶液中加入含Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合
液出现红色,那么由此得出的下列结论,错误的是 ( )
A.该晶体中一定含有SCN- B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+ D.Fe2+与SCN-不能形成红色的化合物
解析:混合液呈现红色,说明Fe3+与SCN-发生了络合反应,由此推知Br2能将Fe2+
氧化为Fe3+,且原晶体中含有SCN-;开始加入Fe2+,溶液颜色无明显变化,说明Fe+
不能与SCN-结合成红色物质。
答案:B
4.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度
等有关,下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④ C.①② D.①③④
解析:Cu与HNO3反应时,Cu与浓HNO3反应产生NO2,而与稀HNO3反应产生NO,产物
不同;Zn与稀H2SO4反应产生H2,而与浓H2SO4反应产生SO2。Cu与FeCl3溶液反应只
生成FeCl2和CuCl2,Fe与HCl溶液反应只生成FeCl2和H2,均与浓度和反应温度无
关。答案:A
3.下列各对试剂中,用来制备硫酸亚铁最合适的是 ( )
A.Fe(NO3)2和稀硫酸 B.Fe(OH)2和稀硫酸
C.Fe3O4和稀硫酸 D.Fe和稀硫酸
解析:事实上,工业上就是用Fe和稀硫酸反应制取硫酸亚铁;A项相当于Fe2+和HNO3
发生氧化还原反应,只能得到Fe3+而得不到FeSO4;B项不易得到Fe(OH)2;C项生成
的物质不纯。
答案:D
2.下列物质可由相应的单质直接化合而成的是 ( )
①FeS ②CuS ③FeCl2 ④Al2S3 ⑤Fe3O4 ⑥Fe2O3
A.①③⑤ B.②③④ C.①④⑤ D.①②③④⑤
解析:Fe与Cl2化合生成FeCl3而不是FeCl2,因此选项中有(3)即错误,所以选C。
经验证,选项C中的所有物质均可由相应的单质直接化合而成。
答案:C
1.误食亚硝酸盐会使人体中毒,因为亚硝酸盐会使人体血红蛋白中的Fe2+转化为
Fe3+,使血红蛋白丧失与O2结合的能力。服用维生素C可以缓解亚硝酸盐的中毒,
这说明维生素C具有 ( )
A.氧化性 B.还原性 C.酸性 D.碱性
解析:因亚硝酸盐会使人体血红蛋白中Fe2+转化为Fe3+,说明亚硝酸盐有氧化性,
维生素C可以缓解亚硝酸盐中毒,故维生素C具有还原性。
答案:B
15.(2009·锦州一中高三期中考试11月)将碳酸钠和碳酸氢钠的混合物27.4 g,加热到质量不再变化时剩余物质的质量为21.2 g。再另取试样27.4 g,加入某浓度盐酸100 mL恰好完全反应。
(1)求混合物中Na2CO3和NaHCO3的质量;
(2)计算盐酸的物质的量浓度;
(3)标准状况下,一份试样与盐酸反应,共产生CO2多少毫升?
解析:发生的反应有①2NaHCO3Na2CO3+H2O+CO2↑
②NaHCO3+HCl===NaCl+H2O+CO2↑
③Na2CO3+2HCl===2NaCl+H2O+CO2↑
(1)设混合物中Na2CO3和NaHCO3物质的量分别为x、y可列方程组
解得
∴m(Na2CO3)=10.6 g,m(NaHCO3)=16.8 g
(2)反应②和反应③共消耗HCl为n(HCl)=0.2 mol+0.1 mol×2=0.4 mol所以盐酸的物质的量浓度为:0.4 mol÷0.1 L=4 mol/L
(3)由反应②和反应③可知,产生CO2为n(CO2)=0.2 mol+0.1 mol=0.3 mol。即在标准状况下V(CO2)=0.3 mol×22.4 L/mol×1 000 mL/L=6 720 mL。
答案:(1)混合物中Na2CO3和NaHCO3的质量分别为10.6 g,16.8 g
(2)c(HCl)=4 mol/L
(3)6 720 mL
14.(2010·模拟题)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)
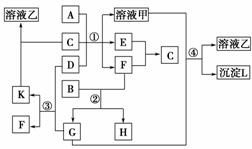
(1)A、B、C、D代表的物质分别为_______、_______、_______、_______(填化学式)。
(2)反应①中的C、D均过量,该反应的化学方程式是_______________________。
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是______、______(填化学式)。
(4)反应③产物中K的化学式为________________________________________。
(5)反应④的离子方程式为____________________________________________。
解析:本题综合考查元素化合物的知识,意在考查考生对元素化合物知识的掌握和综合应用的能力。由C、D的状态可初步推知分别为H2O、Na2O2;H2O、Na2O2二者混合产生氧气、NaOH,结合A、C、D转化为溶液甲、E、F关系可知A为金属Al,则溶液甲为NaAlO2溶液、E、F分别为H2、O2;B为碳单质,与O2反应由O2的量可知会生成CO2和CO,结合反应③、④等转化关系,可知G为CO2,则K为Na2CO3,L是Al(OH)3。这样将上述物质代入图示转化关系完全正确,则说明物质的推断合理。
答案:(1)Al C H2O Na2O2
(2)2Na2O2+2H2O===4NaOH+O2↑,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(3)CO2 CO
(4)Na2CO3
(5)CO2+AlO2-+OH-+H2O===CO32-+Al(OH)3↓
94.(5)b (6)3% 不产生无用的CaCl2(或提高了食盐的转化率等)。
13.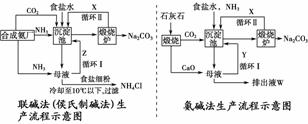 (2010·杭州二中期中考题)联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图:
(2010·杭州二中期中考题)联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图:
(1)沉淀池中发生反应的化学方程式为_____________________________________。
(2)X是________,Y是________(填化学式)。
(3)Z中除了溶解的氨气、食盐外,其它溶质还有____________________;排出液W中的溶质除了氢氧化钙外,还有____________________。
(4)从理论上分析,在氨碱法生产过程中________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为________________________________________________________________________。
(5)根据联碱法从母液中提取氯化铵晶体的过程推测,所得结论正确是_______(填序号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8 L(已析合成标准状况下)时可以得到纯碱100.0 g,则NH3的利用率为________。相比于氨碱法,指出联碱法的一项优点________________________________________________________________________。
解析:(1)两种方法中沉淀池内产生的物质均为NaHCO3和NH4Cl且析出的均是NaHCO3,发生的反应是NH3+H2O+NaCl+CO2===NaHCO3↓+NH4Cl。
(2)两种方法中煅烧炉内发生的反应均是:2NaHCO3Na2CO3+CO2↑+H2O,可见循环的是CO2。氨碱法中:向母液加入CaO后,生成NH3循环利用,排出液W中含有CaCl2及未反应的NaCl、Ca(OH)2等。
(3)联碱法中,母液中含有NaCl、NH3、NH4Cl(少量)、NaHCO3(少量)。
(4)从理论上分析,氨碱法生产中的母液主要含有NH4Cl、NaHCO3,加入过量CaO后,NH4Cl与Ca(OH)2反应生成NH3,显然不用补充氨气;氨碱法发生的反应有①CaCO3CaO+CO2,②2CO2+2NaCl+2H2O+2NH3===2NaHCO3↓+2NH4Cl,③CaO+2NH4Cl===2NH3+CaCl2+H2O,④2NaHCO3Na2CO3+H2O+CO2,①+②+③+④可得:CaCO3+2NaCl===Na2CO3+CaCl2。
(5)增大母液中C(NH4+)和C(Cl-)均可以使NH4Cl析出。
(6)2 mol NH3理论上生成106 g Na2CO3,NH3的利用率为94.3%;从不同点找优点,联碱法不产生无用的CaCl2或提高食盐的利用率。
答案:(1)NaCl+NH3+H2O+CO2===NaHCO3↓+NH4Cl (2)CO2,NH3 (3)NaHCO3、NH4Cl CaCl2、NaCl (4)不需要 CaCO3+2NaCl===CaCl2+Na2CO3
12.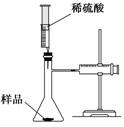 (2010·模拟题)某学校化学科研小组从文献资料上获得如下信息:
(2010·模拟题)某学校化学科研小组从文献资料上获得如下信息:
NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。
为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的
NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为a g的坩埚中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在坩埚中的固体是(填化学式)_______________________________________________________________________。
(2)另称取相同质量的样品放入瓶中,实验装置如图所示。推动针筒逐滴加入稀硫酸,至没有气泡产生为止,共消耗10 mL稀硫酸。为了保证实验成功,所选用的用于测量气体体积的针筒的最大刻度值应大于或等于________mL(设实验在标准状况下进行)。实验中,针筒中收集到的气体折算成标准状况下的体积为V mL(针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y且没有利用化学方程式进行计算,就列出了如下算式:x+y=(V-10)/22 400,他们依据的原理是_________________________________________________。
根据相似原理,请完成下列算式:
2x+y=______________。由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
解析:本实验目的是探究NaHCO3是否发生了分解反应,其实验原理是根据差量法判断,即取84 g样品完全加热后,若剩余固体质量为53 g,说明样品未发生分解,若剩余固体质量大于53 g,说明样品已发生分解反应。(1)样品质量为(b-a)g,剩余固体质量为(c-a)g,坩埚中固体是Na2CO3。(2)假设样品未分解,放出的气体最多且为:×22.4×103 mL;碳原子守恒(碳酸钠与碳酸氢钠中碳原子数之和等于CO2中的碳原子数);“2x+y”是“Na+”的物质的量且等于2n(H2SO4),等于坩埚中Na2CO3物质的量的2倍。
答案:(1)Na2CO3 (2)(b-a)+10 碳原子守恒 ×2(或)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com