
题目列表(包括答案和解析)
6.某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH(溶液),则消耗NaOH溶液
体积(x轴)和生成沉淀量(y轴)之间的函数关系,可用下图表示,则下列图中正确的是 ( )
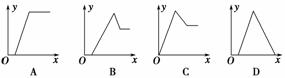
解析:与OH-反应的能力应是H+>Al3+>Mg2+(同浓度下)。此题解法为化学问题数学化(图形化)。
注意:Al3+--Al(OH)3--[AlO2-]-图形是非等腰三角形。
答案:B
5.有镁、铝混合粉末10.2 g,将它溶于500 mL 4 mol/L的盐酸中,若要使沉淀质量达到最大值,
则需加入2 mol/L的氢氧化钠溶液的体积为 ( )
A.1 000 mL B.500 mL C.100 mL D.1 500 mL
解析:利用元素守恒,当沉淀达到最大值时,Na+与Cl-结合,即
n(NaOH)=n(HCl),V(NaOH)==1 000 mL。
答案:A
4.把镁粉中混入的少量铝粉除去,应选用的试剂是 ( )
A.盐酸 B.氯水 C.烧碱溶液 D.纯碱溶液
解析:盐酸跟镁、铝都反应,A错;氯水中有氯气和水反应的生成物--盐酸和次氯酸,镁、铝都会与其反应,B错;烧碱是氢氧化钠,铝有两性,可以跟氢氧化钠溶液反应放出氢气,铝变成偏铝
酸钠溶于水,镁不反应而分离,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,C对;纯碱溶液是碳酸钠溶液,与镁、铝都不反应,D错。
答案:C
3.镁和铝都是较活泼的金属,下列叙述正确的是( )
A.镁不与任何金属氧化物反应,而铝可用于冶炼金属
B.金属镁、铝作电极构成原电池时,负极反应一定为:Mg-2e-===Mg2+
C.MgCl2及AlCl3溶液分别蒸发并灼烧,均可得到氧化镁和氧化铝
D.历史上曾用反应3Na+AlCl3Al+3NaCl制铝;
现代工业用反应Mg+2RbClMgCl2+2Rb↑制铷,所以活动性:Mg>Rb>Na>Al
解析:氯化镁、氯化铝在溶液中均能水解,加热时水解生成的氯化氢从体系中不断逸出,生成的
氢氧化物灼烧后生成氧化物,故C项正确;镁制取铷的反应实际上是利用铷的沸点比镁沸点低,
铷蒸气不断从体系中抽出从而制得铷,不是依据金属活动性大小置换原理,D项不正确。
答案:C
2.下列有关镁的叙述正确的是( )
A.镁条燃烧的火灾可用CO2进行扑灭 B.镁不能与水反应放出H2
C.镁制容器可用来装浓HNO3 D.镁在空气中燃烧产物并不全是MgO
解析:镁是很活泼的金属,具有强还原性,燃着的镁条能够夺取CO2中的氧而继续燃烧,镁条也
能与水反应放出H2,温度低时反应较慢,加热时速度可以加快。镁条在空气中燃烧不仅与氧气化
合生成MgO,还能与少量氮气化合生成Mg3N2。常温时,铝在浓HNO3中钝化,而镁则不能。
答案:D
1.(2009·广东理基)下列有关金属及其合金的说法不正确的是 ( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
解析:本题考查金属的相关知识,主要涉及Mg、Al;B项中生铁、普通钢、不锈钢
中碳含量应是依次减少的,故B错。
答案:B
15.(2009·北京)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和
条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_____________
________________________________________________________________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_________________
________________________________________________________________________。
(3)Ⅲ中,生成FeCO3的离子方程式是_______________________________________
________________________________________________________________________。
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方
程式是___________________________________________________________________
________________________________________________________________________。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-的操作是_______________________________________________________________________
________________________________________________________________________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0 kg
的FeCO3,得到316.8kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是
_______kg。(摩尔质量/g·mol-1:FeCO3-116、Fe2O3-160、FeO-72)
解析:本题综合考查Fe的相关性质、离子方程式的书写、化学方程式的书写、水解规
律的运用、离子检验及化学计算等无机基础知识。
(2)FeSO4+2H2OFe(OH)2+H2SO4,加入H2SO4,平衡逆移,抑制水解。
(3)“红褐色”提示生成Fe(OH)3。
(4)SO42-检验:说明步骤,指明试剂、现象、结论。
(5)设产品中FeO、Fe2O3物质的量分别为a、b。
,
求得:b=1.8×103 mol
m(Fe2O3)=1.8×103 mol×160 g·mol-1=288.0×103 g=228.0 kg。
答案:(1)Fe+2Fe3+===3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2OFe(OH)2+2H+的平衡向逆反应方向移
动,从而抑制FeSO4的水解
(3)Fe2++HCO3-===FeCO3↓+H+
4FeCO3+6H2O+O2===4Fe(OH)3+4CO2
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则
沉淀洗涤干净
(5)288.0
14.如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化,实验时必
须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白:
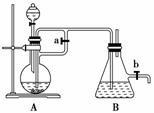
(1)B中盛有一定量的NaOH溶液,A中应预先加入试剂是________。A中反应的离子
方程式是______________________________。
(2)实验开始时应先将活塞a________(填“打开”、“关闭”)。
(3)简述生成Fe(OH)2的操作过程____________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为________________________________________________________________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
解析:制备Fe(OH)2并观察Fe(OH)2在空气中的颜色变化,关键是在无氧环境中制得
Fe(OH)2。本实验中先用H2排出装置内的空气,故实验开始时应先打开活塞a,让生成
的H2排尽装置的空气,然后关闭活塞a,通过烧瓶中气体压强将FeSO4溶液压入锥形瓶
中,即可制得Fe(OH)2,最后打开活塞b,放入空气,即可观察Fe(OH)2的变色情况。
对于(5)各装置均能让Fe2+与OH-在无氧条件下反应,均可长时间观察Fe(OH)2的颜色。
答案:(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开
(3)关闭活塞a,使FeSO4溶液被压入B中进行反应
(4)4Fe(OH)2+2H2O+O2===4Fe(OH)3
(5)①②③④
0.28 g m(H2)
m(H2)==0.013 3 g
V(H2)==0.152 L
故V(H2)=152 mL,应选择200 mL的量筒,若选用500 mL或1 000 mL的量筒,误差太
大。若生成氢气体积为V L,则m(H2)=0.088 V g,消耗铁的质量:m(Fe)=
=1.848 V g
铁的转化率为:×100%=6.6 V×100%。
答案:(1)肥皂泡破裂,有爆鸣声 3Fe+4H2O(g)Fe3O4+4H2 (2)①B
②B ③6.6 V×100%
0.088 g/L,最好选用________规格的量筒(选填字母序号)。
A.100 ml B.200 mL C.500 mL D.1 000 mL
③收集的气体体积为V L,则铁粉的转化率为________。
解析:利用氢气的可燃性可证明铁与水蒸气能反应且产物为氢气。
(2)利用排水法收集并测定H2的体积,A装置,广口瓶中进气管长,出气管短,不能排
出广口瓶中的水,也不能测量H2的体积。根据反应方程式:计算可解决②③,若铁完
全反应,则:
3Fe + 4H2O(g)Fe3O4+4H2
168 g 8 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com