
题目列表(包括答案和解析)
15.(2009×长沙市5月联考题)盐R的化学式为XmYnZp(X、Y、Z三种不同离子),其组
成元素均为短周期元素,取两份等质量等浓度R的水溶液各5 mL进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀
量先增加后减少,量终剩余沉淀甲2.33 g,且甲不溶于稀盐酸。
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体
乙0.112 L(标准状况),乙能使湿润的红色石蕊试纸变蓝。
据此回答。

(1)写出R和甲的化学式:R ,甲 。
(2)另取1 L R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的
物质的量关系如图所示,则:
①R溶液物质的量浓度为 ;②BC段表示的含义是
_____________________________________________________________________;
③CD段表示反应的离子方程式为 。
解析:本题考查离子的推断及图象分析的计算题,属中档题。(1)由实验Ⅰ分析,加
入Ba(OH)2溶液,先沉淀再溶解,显然是Al3+与OH-的反应。沉淀甲不溶于稀盐酸,
不难推理为BaSO4,即R中含有SO -实验Ⅱ,加碱能生成气体,且能使湿润的红色
-实验Ⅱ,加碱能生成气体,且能使湿润的红色
石蕊试纸变蓝,说明是NH4+,故R的化学式为NH4Al(SO4)2。
(2)向NH4Al(SO4)2中加入碱,先生成Al(OH)3沉淀,然后是NH4+与OH-生成NH3,
最后Al(OH)3沉淀溶解。不可能先生成NH3,因为产生的NH3仍会沉淀Al3+,也不
可能先溶解沉淀,否则溶解生成的AlO2-会与NH4+发生水解反应生成Al(OH)3沉淀。
由题意知,5 mL可产生0.112 L的气体,故1 L可产生1 mol NH3,由图象知,产生
NH3所需的NaOH为1 mol,c(R)×V(R)=1,故c(R)=1 mol/L。
答案:(1)NH4Al(SO4)2 BaSO4
(2)①1 mol/L ②NH4+与OH-生成NH3×H2O
③Al(OH)3+OH-===AlO2-+2H2O
14.(2010×模拟题)溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,工业上
用电解饱和食盐水生成氯气生产溴酸钾的工艺流程如下:

(1)电解饱和食盐水的离子方程式为
_______________________________________________________________________。
(2)“合成Ⅰ”发生反应的化学方程式为
_______________________________________________________________________;
“合成Ⅲ”发生反应的原因是
_______________________________________________________________________。
(3)加入MgO目的是
_______________________________________________________________________。
(4)“过滤Ⅰ”得到的滤渣主要成分为________。
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤,加热到370℃分解为溴化
钾和氧气。然而美、日等国都允许在油炸薯片中添加一定量溴酸钾,以改善薯片的口
感。我国也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全面禁止在食品
中使用溴酸钾。从化学原理分析推测,有关国家认为在油炸薯片中添加溴酸钾是“安
全”的理由是(用化学方程式表示)_
________________________________________________,而我国认为不安全的理由是
_______________________________________________________________________。
解析:本题以溴酸钾的制备和在食品中的应用为载体,主要考查电解饱和食盐水、单
质溴的性质、氯化镁的性质、溴酸钾的性质等,综合性很强,有利于培养学生分析问题和解决问题的能力,较难。“合成Ⅰ”中发生的反应,很容易根据思维定势写成溴与水或
氯气与水的反应,应该结合实验目的(制备溴酸钾)和物质的性质(氯气和溴具有很强的
氧化性),写出发生反应;加入过量MgO后,MgO被生成的两种酸(HCl、HBrO3)溶
解,根据流程图可推知“合成Ⅲ”反应后生成了溴酸钾,故此时一定发生了下列反应:
2KCl+Mg(BrO3)2===2KBrO3+MgCl2,因为流程图中有“过滤Ⅱ”,所以可推知溴酸
钾留在溶液中,再结合复分解反应发生的条件,可以推断此时应有晶体析出且晶体是
 氯化镁;结合信息写出方程式,并解释造成“不安全”的原因还是溴酸钾的存在。
氯化镁;结合信息写出方程式,并解释造成“不安全”的原因还是溴酸钾的存在。
答案:(1)2Cl-+2H2O Cl2↑+H2↑+2OH-
(2)5Cl2+Br2+6H2O===2HBrO3+10HCl MgCl2在饱和溶液中易结晶析出,有利于
KBrO3的生成
(3)中和“合成Ⅰ”溶液中H+,促进BrO3-的生成,有利于“合成Ⅲ”中KBrO3与
Cl-(MgCl2)的分离,提高产品纯度
(4)MgO
(5)2KBrO3 2KBr+3O2↑ 油炸或烘焙的温度条件下不能保证KBrO3完全分解生成
2KBr+3O2↑ 油炸或烘焙的温度条件下不能保证KBrO3完全分解生成
无毒的KBr,残留KBrO3会引起食物中毒
13.(2010×华师一附中期中考题)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,Cu2+与I-作用可生成I2,I2溶于过量的KI溶液中:I2+I-===I3-,
又知氧化性:Fe3+>Cu2+>I2>FeF -;生成的I2可用c mol×L-1 Na2S2O3标准溶液滴定,
-;生成的I2可用c mol×L-1 Na2S2O3标准溶液滴定,
其反应为:2S2O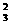 -+I3-===S4O
-+I3-===S4O -+3I-。
-+3I-。
操作:准确称取a g胆矾试样[可能含少量Fe2(SO4)3],置于250 mL碘量瓶(带磨口塞
的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol×L-1 H2SO4溶液、少量NaF,再加入足量
的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入指示剂,
用Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液。回答下列问题:
(1)实验中,加KI前需加入少量NaF,其作用可能是
______________________________;加3 mol×L-1 H2SO4溶液的作用可能是
________________________________________________________________________。
(2)滴定实验中所用指示剂是________;滴定终点的判断方法为
_______________________________________________________________________。
(3)本实验中用碘量瓶而不用普通锥形瓶是因为
_______________________________________________________________________。
(4)硫酸铜与碘化钾反应后,Cu2+被还原成白色的碘化亚铜沉淀,该反应的离子方程
式为________________________________________________________________
______________________________________________________________。
(5)根据实验结果,写出胆矾中铜含量的表达式________________。
解析:本题考查胆矾中铜含量的测定原理与方法,属中档题。其原理是Cu2+先与I-
反应生成I2,然后再用Na2S2O3滴定,计算出I2的量即可算出Cu的含量。(1)当溶液
中有Fe3+时,也可以将I-氧化,最终影响Cu2+含量的测定。
(2)选用淀粉作指示剂的原因是,当Na2S2O3将I2全部反应时,颜色将发生改变,由
蓝色而变成无色。(3)I-易被氧化,所以要避免O2的接触。(4)根据题意,写出产物,
然后抓化合价升降总值相等的原则配平。(5)找出物质的关系为2Cu2+-I2-2S2O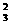 -,
-,
则可顺利求解。
答案:(1)使氧化性强的Fe3+转化为弱氧化性的FeF -,防止其氧化I-而影响Cu2+量
-,防止其氧化I-而影响Cu2+量
的测定 提供酸性环境,抑制Cu2+水解。
(2)淀粉溶液 当加入最后一滴标准溶液时,锥形瓶中溶液恰好由蓝色转变为无色且
半分钟内颜色不再变化即到达滴定终点
(3)加盖磨口塞可防止空气进入锥形瓶氧化I-,影响I2的量的测定
(4)2Cu2++4I-===2CuI↓+I2(或2Cu2++5I-===2CuI↓+I )
)
(5) ´100%
´100%
12.(2010×济宁市育才中学期中考题)碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)
是一种农药,分子式:CuCl2×3Cu(OH)2×xH2O(x=1/2,1,2)。为验证其组成并确定x值,
某学生设计了以下几步实验:
①取a g晶体研成粉末。
②晶体在空气中加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g晶体,溶于足量某溶液中充分溶解得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
(1)以上实验中用到玻璃棒的步骤有________(填序号)。
(2)步骤②中晶体应放在________(填仪器名称)中灼烧,灼烧后得到的固体应为
________(填化学式)。
(3)步骤③所用的溶液可能是________。
(4)步骤④主要包括:加入足量硝酸银溶液→________→________→晾干→称量。
(5)若组成符合通式,则可以计算x的物理量组合是________(填序号)。
A.a、b B.a、c C.b、c D.a、b、c缺一不可
解析:本题考查化学实验的基本技能。难度中等。(1)在出现的操作中,②需要玻璃
棒加以搅拌以防止固体飞溅,③中用到玻璃棒以加快溶解,④中用到玻璃棒是过滤时
的导流作用,故选择②③④;(2)对固体的加热应该在坩埚中进行,灼烧时CuCl2水
解生成Cu(OH)2,Cu(OH)2发生分解生成CuO,所以经过灼烧后得到的固体应该只有
CuO;(3)要将碱式氯化铜溶解,并测定相关成分,显然不能使用盐酸,而氯离子的
测定是通过AgNO3来进行的,所以不能选择硫酸,只能选择硝酸;(4)先生成沉淀,
然后再过滤、洗涤、干燥即可;(5)要得到x,必须将样品质量与加热后的固体或者是
生成的AgCl沉淀相联系,故需要的数据是a、b或者是a、c,选择A、B。
答案:(1)②③④ (2)坩埚 CuO (3)HNO3 (4)过滤 洗涤 (5)AB
11. (2010×模拟题)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。制备碘酸钙的实验流程如下。中间产物碘酸氢钾的合成原理为:
(2010×模拟题)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。制备碘酸钙的实验流程如下。中间产物碘酸氢钾的合成原理为:
I2+2KClO3+HCl KH(IO3)2+KCl+Cl2↑。

回答下列问题:
(1)制备碘酸氢钾的实验装置(支撑仪器及加热装置略去)如图,请在方框中补充必要的
装置图并注明试剂。

(2)若为上图增添加热装置,所需仪器除铁架台(带铁圈)、石棉网外还有
_______________________________________________________________________。
(3)实验中判断碘反应完全的实验现象是
_______________________________________________________________________。
(4)“调pH至10”的目的是
_______________________________________________________________________。
(5)加入CaCl2时反应的化学方程式为________________________。
(6)从水溶液中分离出碘酸钙时,可能得到无水盐、一水合物、六水合物等,本实验
得到的产品是Ca(IO3)2×6H2O,上述流程中与此结果密切相关的步骤是
_______________________________________________________________________。
解析:本题考查物质的制备。(1)氯气用NaOH溶液来吸收;(2)从流程看出反应条件
需要恒温,所以需要温度计;(3)碘单质反应完全时,碘水的颜色会褪去;(4)因为实
验的目的是为了制备碘酸钙,所以要将生成的KH(IO3)2转化为KIO3;(6)切记不能蒸
发,否则产物会分解。
答案:(1)

(2)酒精灯、烧杯、温度计(或恒温电炉等) (3)反应混合溶液变为无色 (4)将KH(IO3)2
转化为KIO3 (5)2KIO3+CaCl2===Ca(IO3)2↓+2KCl (6)冰水中静置
10.(2010×原创题)某学生对甲盐进行以下实验操作:

下列结论不正确的是( )
A.甲中一定含有Br-和Fe2+或Fe3+或Fe2+和Fe3+至少有一种
B.丙中一定含有Fe3+
C.乙为AgI
D.丁中含有[Fe(SCN)2]+
解析:向甲中加入酸化的AgNO3(aq),即使甲中不含Fe3+,含Fe2+时,也会导致丙中
一定含有Fe3+;乙为AgBr,AgI为黄色。
答案:C
9.(2010×苏州中学期中考题)已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性。ICl
与Zn、H2O分别发生如下反应:2ICl+2Zn===ZnCl2+ZnI2、ICl+H2O===HCl+HIO。下
列说法正确的是( )
A.在Zn与ICl的反应中,ZnI2既是氧化产物又是还原产物
B.在Zn与ICl的反应中,ZnCl2既不是氧化产物又不是还原产物
C.在H2O与ICl的反应中,ICl既是氧化剂又是还原剂
D.在H2O与ICl的反应中,ICl是氧化剂
解析:ICl中I为+1价,Cl为-1价,分析反应中元素化合价的变化就可以得出结论。
答案:A
8.(浙江五校5月)现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的
相互反应,图中每条连线两端的物质可以发生化学反应。下列判断不合理的是( )
A.X一定为H2SO4 B.Y一定为K2CO3
C.Z可能是氯水 D.M可能为FeSO4
解析:H2SO4能与BaCl2、K2CO3反应;BaCl2能与H2SO4、K2CO3、FeSO4反应;K2CO3
能与H2SO4、BaCl2、FeSO4、氯水反应;FeSO4能与BaCl2、K2CO3、氯水反应;氯
水能与K2CO3、FeSO4反应,所以根据图形只能判断出Y一定是K2CO3,其他物质
不能准确判断,A项错误。
答案:A
7.已知三角锥形分子E和直线型分子G反应,生成两种直线型分子L和M(组成E、G、
L、M分子的元素原子序数均小于10),如下图所示,则下列判断错误的是( )

A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
解析:结合题意和图示可知该反应为:2NH3+3F2===6HF+N2,则E为NH3,G为F2,
L为HF,M为N2。F2是最活泼的非金属单质,HF是极性分子,NH3能使紫色石蕊
试液变蓝,A、B、C均正确;N2分子中含有3个共价键而不易断裂,化学性质不活
泼,D错。
答案:D

6.(2010×郑州47中期中考题)氰(CN)2被称为拟卤素,其性质与氯气相似,但也有不同,
如(CN)2(g)在O2(g)中燃烧生成两种空气成分气体。氰化物有毒,电镀厂向含氰化物
的电镀废液中加入漂白粉,可将有毒的CN-氧化成氮气。下列说法中正确的是( )
A.CN-的电子式为×C⋮⋮N
B.可用氰与石灰乳反应制备漂白粉,用于日常漂白、消毒
C.漂白粉中能与CN-反应的物质是CaCl2
 D.氰在氧气中燃烧的化学方程式为:(CN)2+2O2 2CO2+N2
D.氰在氧气中燃烧的化学方程式为:(CN)2+2O2 2CO2+N2
解析:CN-的电子式为[ C⋮⋮N
C⋮⋮N ]-,制漂白粉是Cl2与石灰乳反应,B项错误;氰化
]-,制漂白粉是Cl2与石灰乳反应,B项错误;氰化
物有毒,氯化钙无强氧化性,不能将CN-氧化成氮气;(CN)2(g)在O2(g)中燃烧生成两
 种空气成分气体,反应方程式为(CN)2+2O2 2CO2+N2,D项正确。
种空气成分气体,反应方程式为(CN)2+2O2 2CO2+N2,D项正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com