
题目列表(包括答案和解析)
4.下列制备金属单质的方法或原理正确的是 ( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
解析:A项,Mg是十分活泼的金属,应采用电解熔融MgCl2的方法制取;C项,
Na能与水反应,从NaCl的水溶液中不可能制备Na,应采用电解熔融NaCl制备
Na;D项,利用CuO制备Cu,应采用热还原法,如H2+CuOCu+H2O。
答案:B
3.工业上冶炼金属一般用热分解法、热还原法和电解法,不同的金属应选用不同的冶
炼方法。选择的原则主要是依据 ( )
A.金属的熔点高低 B.金属在自然界中的存在形式
C.金属离子得电子的能力 D.金属的使用价值
解析:金属冶炼方法的选择依据是金属离子的氧化性强弱,即得电子能力的大小。
答案:C
2.下列关于金属单质Na、Al、Fe、Cu的叙述正确的是 ( )
A.与氧气反应一定都生成最高价氧化物
B.四种金属元素在周期表中全部分布在主族或副族中
C.都可以在氯气中燃烧生成最高价氯化物
D.在点燃或高温条件下,它们都可以与水或水蒸气反应
解析:A项中,Fe在氧气中燃烧得到Fe3O4,其中Fe的化合价含有+2价;B项中,
Fe元素位于周期表中第四周期第Ⅷ族,不属于副族;C项中,由于氯气具有强氧化
性,当它与其他物质(单质)化合时,一定将其他物质(单质)氧化为最高价态;D
中,金属钠与冷水反应、金属铝与沸水反应、金属铁与水蒸气反应,而金属铜不能
与水反应。
答案:C
1.我国成功地发射了嫦娥一号探测卫星,确定对月球土壤中14种元素的分布及含量
进行探测等。月球的矿产资源极为丰富,仅月球表面5 cm厚的沙土就含铁单质有
上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石
[(Mg·Fe)SiO4](可看作为Mg2SiO4·Fe2SiO4)等。下列说法或分析不正确的是 ( )
A.辉石、斜长石及橄榄石均属于硅酸盐矿
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
解析:由矿物的分子式可知三种矿物均属于硅酸盐矿,A项正确;斜长石改写为
K2O·Al2O3·6SiO2,B项正确;橄榄石中由正负化合价代数和为零可知铁为+2价,
C项正确;月球上铁呈游离态,是因为月球上无氧气,D项错误。
答案:D
15.(2010×原创题)Ⅰ.用一种试剂除去下列各物质中的杂质(括号中的物质),写出所用试剂及离子方程式,并简述操作方法。
(1)BaCl2(HCl)试剂__________________________________________ ;
离子方程式________ __________________ __________________;
操作方法________________________________________________________。
(2)O2(CO2)试剂__________________________________________________;
离子方程式___________________________________________________ ;
操作方法____________ _______________________________________。
(3)Cu(Zn)试剂___________________________________________ ;
离子方程式________________________________________ ;
操作方法___________ __________________________________。
Ⅱ.在下列物质中选择反应物Cl2、CuSO4、Fe、Fe(NO3)2、FeCl3、HCl、KI,按下列要求写出相应的离子方程式。
(1)一种单质氧化一种阴离子____ ______________________________;
(2)一种阳离子氧化一种阴离子________________________ _____;
(3)一种单质氧化一种阳离子_______________________ _____;
(4)一种单质还原一种离子并生成新的阳离子_________________________;
(5)一种阴离子氧化一种阳离子_______________________________ _____。
解析:Ⅰ.(1)BaCl2(HCl),显然是BaCl2溶液中含有盐酸,只需把H+除去,但又不能引进新的杂质,最好选用BaCO3,直到BaCO3不溶解,然后过滤即可,或者向溶液中滴加Ba(OH)2至溶液显中性。
(2)采用洗气法将CO2气体吸收。
(3)加入过量盐酸后过滤或加入足量CuSO4溶液后过滤,后者更好。
Ⅱ.首先要将题给物质分为两类,一类是强氧化性物质:Cl2、FeCl3、(NO +H+);一类是还原性物质:Fe、Fe(NO3)2、KI。然后根据题目要求选择反应物。
+H+);一类是还原性物质:Fe、Fe(NO3)2、KI。然后根据题目要求选择反应物。
答案:Ⅰ.(1)BaCO3或Ba(OH)2 BaCO3+2H+===Ba2++H2O+CO2↑或H++OH-===H2O 过滤或调至中性
(2)NaOH(aq) CO2+2OH-===H2O+CO 洗气
洗气
(3)CuSO4(aq)或盐酸 Cu2++Zn===Zn2++Cu或Zn+2H+===Zn2++H2↑ 过滤
Ⅱ.(1)Cl2+2I-===2Cl-+I2
(2)2Fe3++2I-===2Fe2++I2
(3)Cl2+2Fe2+===2Cl-+2Fe3+
(4)2Fe3++Fe===3Fe2+
(5)3Fe2++NO +4H+===NO↑+3Fe3++2H2O
+4H+===NO↑+3Fe3++2H2O
14.A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO SO SO HSO HSO |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
Ⅰ.A____________;B____________;C____________;D____________;E____________。
Ⅱ.请完成下列实验步骤的离子方程式:
(1)步骤①中生成白色沉淀的离子方程式 。
(2)步骤②中白色沉淀溶解的离子方程式 。
(3)步骤④中白色沉淀减少的离子方程式
Ⅲ.为确定E中的阳离子还应进行的实验操作是
。
解析:Ⅰ.本题为常见物质推断题的题型。取材为常见离子组成的物质。基本解法为寻觅“突破口”法。本题从物质A突破,A均能与B、C、D反应生成白色沉淀,可推知A中含有CO ,CO
,CO 只能与Na+组成可溶于水的固体,故A为Na2CO3。白色沉淀分别为Mg(OH)2、Al(OH)3、BaCO3。能够溶解两种白色沉淀的只有可能含有HSO
只能与Na+组成可溶于水的固体,故A为Na2CO3。白色沉淀分别为Mg(OH)2、Al(OH)3、BaCO3。能够溶解两种白色沉淀的只有可能含有HSO 即E为NaHSO4或Mg(HSO4)2。B、C中含有Mg2+、Al3+,D中含有Ba2+,由④可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2。
即E为NaHSO4或Mg(HSO4)2。B、C中含有Mg2+、Al3+,D中含有Ba2+,由④可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2。
Ⅱ.在第一个问题分析的基础上,可知①中的白色沉淀为Al(OH)3,是Al3+与CO 发生双水解的产物;②中的白色沉淀为MgCO3,可与HSO
发生双水解的产物;②中的白色沉淀为MgCO3,可与HSO 电离出的H+反应;④中的白色沉淀为BaSO4和Al(OH)3,Al(OH)3可继续与OH-反而溶解。
电离出的H+反应;④中的白色沉淀为BaSO4和Al(OH)3,Al(OH)3可继续与OH-反而溶解。
Ⅲ.为确定阳离子的存在,应进行焰色反应实验。
答案:Ⅰ.Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2 NaHSO4[或Mg(HSO4)2]
Ⅱ.(1)2Al3++3CO +3H2O===2Al(OH)3↓+3CO2↑
+3H2O===2Al(OH)3↓+3CO2↑
(2)MgCO3+2H+===Mg2++CO2↑+H2O
(3)Al(OH)3+OH-===AlO +2H2O
+2H2O
Ⅲ.用铂丝蘸取E的溶液,在酒精灯的火焰上灼烧,若火焰呈黄色则为Na+,否则为Mg2+
13.Ⅰ.用溶质的质量分数为10%的盐酸做导电性实验,然后均匀通入氨气,随着氨气的通入,电流计的读数①________,其原因是②________________。用溶质的质量分数为10%的氨水做导电性实验,然后均匀通入氯化氢气体,随着HCl的通入,电流计的读数③________,其原因是④________________。
Ⅱ.(1)向Ba(OH)2溶液中逐滴加入NaHSO4至恰好不再生成沉淀时为止,写出反应的离子方程式:____________________;在以上溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式:
________________________________________________________________。
(2)向FeI2溶液中加入溴水至过量,反应的离子反应方程式为________________________________________________________________。
(3)向NaOH溶液中滴加少量的Mg(HCO3)2溶液,其离子反应方程式为________________________________________________________________。
解析:Ⅰ.向盐酸中均匀通入NH3时,发生的反应为HCl+NH3===NH4Cl,溶液中的自由移动的离子H+变为NH ,Cl-未变化,溶液中自由移动的电荷的浓度基本不变,因而导电能力不会发生变化;向氨水中均匀通入HCl时,发生的反应为HCl+NH3·H2O===NH4Cl+H2O,因为NH3·H2O为弱电解质,原溶液中自由移动的离子浓度很小,当反应发生后,生成NH4Cl为强电解质,使自由移动离子浓度增大了,导电能力增强了。
,Cl-未变化,溶液中自由移动的电荷的浓度基本不变,因而导电能力不会发生变化;向氨水中均匀通入HCl时,发生的反应为HCl+NH3·H2O===NH4Cl+H2O,因为NH3·H2O为弱电解质,原溶液中自由移动的离子浓度很小,当反应发生后,生成NH4Cl为强电解质,使自由移动离子浓度增大了,导电能力增强了。
Ⅱ.(1)假设有1 mol Ba(OH)2,恰好不再生成沉淀时需要1 mol NaHSO4,发生的反应为:Ba2++OH-+H++SO ===H2O+BaSO4↓;当继续滴加NaHSO4溶液时,只发生:H++OH-===H2O。
===H2O+BaSO4↓;当继续滴加NaHSO4溶液时,只发生:H++OH-===H2O。
(2)假设有1 mol FeI2,即1 mol Fe2+和2 mol I-,需要1.5 mol Br2,发生的反应为2Fe2++4I-+3Br2===2Fe3++2I2+6Br-。
(3)假设Mg(HCO3)2为1 mol,NaOH是过量的,发生的反应为Mg2++2HCO +4OH-===2CO
+4OH-===2CO +Mg(OH)2↓+2H2O。
+Mg(OH)2↓+2H2O。
答案:Ⅰ.①基本不变 ②发生反应:NH3+H+===NH ,单位体积的溶液中离子数目不变、离子电荷数也不变
,单位体积的溶液中离子数目不变、离子电荷数也不变
③增大 ④发生反应:NH3×H2O+H+===NH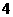 +H2O,由弱电解质转变为可溶性强电解质,单位体积的溶液中离子数目增多
+H2O,由弱电解质转变为可溶性强电解质,单位体积的溶液中离子数目增多
Ⅱ.(1)Ba2++H++OH-+SO ===BaSO4↓+H2O H++OH-===H2O
===BaSO4↓+H2O H++OH-===H2O
(2)2Fe2++4I-+3Br2===2Fe3++2I2+6Br-
(3)Mg2++2HCO +4OH-===2CO
+4OH-===2CO +Mg(OH)2↓+2H2O
+Mg(OH)2↓+2H2O
12.(2010×模拟题)Ⅰ.太湖蓝藻再次暴发,造成无锡市自来水水源地水质的严重恶化。这次事件再次敲响了我国水危机的警钟。太湖流域某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含有Fe3+、Ba2+、K+、OH-、Cl-、CO 、SO
、SO 。为了进一步确认,取样进行实验检测:
。为了进一步确认,取样进行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是________,肯定没有的离子是________,可能含有的离子是________。
(2)如何通过实验进一步确定溶液中可能存在的离子?
Ⅱ.实验室为自然科学(化学)兴趣小组的同学准备了四种红色溶液,它们分别可能是KMnO4酸性溶液、滴有酚酞的NaOH溶液、滴有石蕊的稀硫酸和品红溶液。另外还提供了常见的仪器和药品。为了培养同学们的创新精神和实践能力,老师规定只允许选用一种试剂对上述四种溶液加以鉴别。
(1)甲组同学选用了FeCl2溶液,试写出该组同学鉴别出NaOH溶液的有关离子方程式:______________________________________________ 。
(2)乙组同学选用了Na2SO3溶液,他们第一步鉴别出来的溶液是________,对应的现象分别是____________________。还需继续完成的实验是
_________________________________________________________________
_________________________________________________________________
________________(请简要写明操作步骤、现象和结论)。
(3)丙组同学选用了甲、乙两组另外的一种试剂,鉴别时较甲、乙两组在操作上更为简便,你认为他们选择的试剂可能是__________________________________________________________________。
解析:Ⅰ.由①可知,不存在能发生反应生成沉淀的离子;由②可知肯定存在Ba2+,判断一定不存在CO 、SO
、SO ;由③可知存在OH-,判断一定不存在Fe3+。那么无法判断K+和Cl-存在否。
;由③可知存在OH-,判断一定不存在Fe3+。那么无法判断K+和Cl-存在否。
Ⅱ.(1)检验Fe2+方法可利用Fe(OH)2的性质(白色絮状沉淀迅速变为灰绿色,最后变为红褐色)。

 (3)丙组试剂的选择依据OH-+NH
(3)丙组试剂的选择依据OH-+NH NH3↑+H2O,MnO
NH3↑+H2O,MnO 具有氧化性可将S2-、SO
具有氧化性可将S2-、SO 氧化,因而可组成为(NH4)2SO3或NH4HSO3、(NH4)2S、NH4HS。
氧化,因而可组成为(NH4)2SO3或NH4HSO3、(NH4)2S、NH4HS。
答案:Ⅰ.(1)Ba2+、OH- Fe3+、CO 、SO
、SO K+、Cl-
K+、Cl-
(2)用铂丝蘸少量试液在酒精灯火焰上灼烧,透过蓝色钴玻璃,若发现火焰呈紫色,则说明含有K+。另取少量试液于一洁净试管中,加几滴AgNO3溶液,若有白色沉淀生成,再加入HNO3后沉淀不溶解,则说明溶液中含有Cl-。
Ⅱ.(1)Fe2++2OH-===Fe(OH)2↓;(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)KMnO4酸性溶液;稀硫酸 红色褪去;产生无色刺激性气味气体。(以下答题具有开放性,答案不唯一) 另取未鉴别出的两待测液,分别向其中滴加稀H2SO4,红色褪去者为NaOH溶液,剩余为品红溶液。或:另取未鉴别出的两待测液,分别向其中滴加KMnO4酸性溶液,红色褪尽者为品红溶液,余者为NaOH溶液。或:另取未鉴别出的两待测液,并以稀H2SO4和Na2SO3反应产生的SO2分别通入到两待测液中,红色褪去,取褪色溶液加热,重新变红者为品红溶液,余者为NaOH溶液
(3)(NH4)2SO3或NH4HSO3、(NH4)2S或NH4HS
11.(2010×河南省实验中学期中考题)Ⅰ.有以下三组实验

(1)实验Ⅰ的目的是 。
(2)实验Ⅱ证明了 离子和 离子之间发生了化学反应,根据什么现象证明溶液中的另外两种离子没有发生化学反应 。
(3)实验Ⅲ中反应的离子方程式为 。
Ⅱ.某废水样品中含有一定量的Na+、CO 、SO
、SO ,甲、乙两研究小组欲测定其中SO
,甲、乙两研究小组欲测定其中SO 的浓度。
的浓度。
甲组方案:
①加盐酸 ②加BaCl2溶液③系列操作
试剂X从下列试剂中选择:
a.0.1 mol×L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol×L-1 NaOH溶液
c.新制氯水
d.KI溶液
(1)加入试剂X后生成SO 的离子方程式为 ;
的离子方程式为 ;
(2)甲组方案中,第③步的“系列操作”包含的操作名称各为 ;
乙组方案:
①用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
②精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol×L-1 KMnO4(H2SO4酸化)溶液进行滴定;(有关反应为:2MnO +5SO
+5SO +6H+===2Mn2++5SO
+6H+===2Mn2++5SO +3H2O)
+3H2O)
③记录数据,计算。
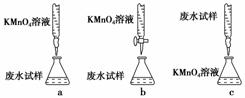
(3)乙组设计的下列滴定方式中,最合理的是(夹持部分略去)________(填字母序号)。
解析:Ⅰ.不会有什么明显现象,CuSO4溶液仍呈蓝色,说明Na+与SO 、Cu2+与Cl-均不发生反应;(Ⅱ)会观察到有白色沉淀且溶液仍呈蓝色,结合(Ⅰ)的实验现象,判断白色沉淀是Ba2+和SO
、Cu2+与Cl-均不发生反应;(Ⅱ)会观察到有白色沉淀且溶液仍呈蓝色,结合(Ⅰ)的实验现象,判断白色沉淀是Ba2+和SO 反应生成的,溶液蓝色是含有Cu2+的缘故;(Ⅲ)会观察到有白色沉淀且溶液仍呈蓝色,说明Cu2+未反应,反应的是Cl-和Ag+。
反应生成的,溶液蓝色是含有Cu2+的缘故;(Ⅲ)会观察到有白色沉淀且溶液仍呈蓝色,说明Cu2+未反应,反应的是Cl-和Ag+。
Ⅱ.由甲组方案流程可知,试剂X将SO 转化成SO
转化成SO ,通过测定m(BaSO4)得n(BaSO4)=n(SO
,通过测定m(BaSO4)得n(BaSO4)=n(SO ),显然溶液中不能引入SO
),显然溶液中不能引入SO ,即a组试剂不可以,b、d均不能将SO
,即a组试剂不可以,b、d均不能将SO 转化成SO
转化成SO 。乙组方案中酸性KMnO4溶液应盛放在酸式滴定管中。
。乙组方案中酸性KMnO4溶液应盛放在酸式滴定管中。
答案:Ⅰ.(1)证明Cl-与Cu2+不发生反应
(2)Ba2+ SO 溶液仍为蓝色,说明Cu2+与Cl-没有发生化学反应
溶液仍为蓝色,说明Cu2+与Cl-没有发生化学反应
(3)Ag++Cl-===AgCl↓
Ⅱ.(1)Cl2+SO +H2O===2Cl-+SO
+H2O===2Cl-+SO +2H+
+2H+
(2)过滤、洗涤、干燥 (3)b
10.(2010×原创题)下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性
H++SO +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
B.标准状况下将112 mL氯气通入10 mL 1 mol/L的碘化亚铁溶液中
3Cl2+2Fe2++4I-===6Cl-+2Fe3++2I2
C.用硫化亚铁与稀硝酸反应制H2S气体
FeS+2H+===Fe2++H2S↑
D.向澄清石灰水中加入过量的碳酸氢钠溶液
Ca2++2OH-+2HCO ===CaCO3↓+2H2O+CO
===CaCO3↓+2H2O+CO
解析:A项中,溶液呈中性,必须使n(NaHSO4)∶n[Ba(OH)2]=2∶1,其反应方程式为:2H++SO +Ba2++2OH-===BaSO4↓+2H2O,A项不正确;B项中,Cl2先氧化I-,再氧化Fe2+,n(Cl2)=0.005 mol,n(FeI2)=0.01 mol,只发生Cl2+2I-=2Cl-+I2,B项不正确;C项中稀HNO3能氧化H2S,C项不正确。
+Ba2++2OH-===BaSO4↓+2H2O,A项不正确;B项中,Cl2先氧化I-,再氧化Fe2+,n(Cl2)=0.005 mol,n(FeI2)=0.01 mol,只发生Cl2+2I-=2Cl-+I2,B项不正确;C项中稀HNO3能氧化H2S,C项不正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com