
题目列表(包括答案和解析)
5.(2010·太原十中月考题)甲、乙、丙均为中学化学常见的气体单质,A、B、C均为常见的化合物。
已知:①甲与乙反应生成A是工业生产中常见的反应之一;
②甲与乙在一定条件下反应的有关数据为:
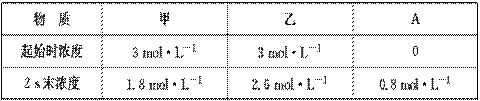
3它们之间存在如下图所示的转化关系:
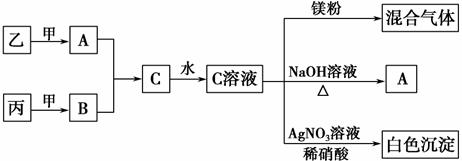
根据上述信息,回答下列问题:
(1)乙的电子式为____________。
(2)C晶体中所含的化学键有________________。
(3)甲与乙反应的化学方程式为____________________________________________,
在前2 s内甲的平均反应速率v(甲)=________,2 s末乙的转化率为________。
(4)常温下,1 g甲在丙中燃烧生成气态B,放出92.3 kJ热量,写出该反应的热化学
方程式: ______。
(5)C溶液与镁粉反应生成混合气体的化学式可能为________,试分析产生混合气体
的原因_______。
解析:有两种气体单质参与的工业生产中常见的反应为合成氨的反应:N2+3H2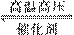
 2NH3,结合表中数据,推知甲、乙转化量之比为:(3 mol·L-1-1.8 mol·L-)∶(3 mol·L-1-2.6 mol·L-1)=3∶1,结合合成氨的反应可知甲为H2,乙为N2。分析框图,B也是氢化物,能与NH3反应,B为HCl,丙为Cl2。NH3与HCl反应生成的氯化铵既含有离子键又含有共价键,氯化铵水溶液呈酸性,能与镁粉反应产生氢气,随着H+的消耗,平衡NH4++H2O
2NH3,结合表中数据,推知甲、乙转化量之比为:(3 mol·L-1-1.8 mol·L-)∶(3 mol·L-1-2.6 mol·L-1)=3∶1,结合合成氨的反应可知甲为H2,乙为N2。分析框图,B也是氢化物,能与NH3反应,B为HCl,丙为Cl2。NH3与HCl反应生成的氯化铵既含有离子键又含有共价键,氯化铵水溶液呈酸性,能与镁粉反应产生氢气,随着H+的消耗,平衡NH4++H2O NH3·H2O+H+正向移动,生成的NH3·H2O会分解产生NH3。1 g H2与Cl2反应放出92.3 kJ热量,则1 mol H2参与反应时放出184.6 kJ热量,放热反应的ΔH为负值。
NH3·H2O+H+正向移动,生成的NH3·H2O会分解产生NH3。1 g H2与Cl2反应放出92.3 kJ热量,则1 mol H2参与反应时放出184.6 kJ热量,放热反应的ΔH为负值。
答案:(1):N⋮⋮N:· (2)离子键、共价键 (3)N2+3H2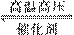 2NH3
2NH3
4.(2010·南京师大附中1月考题)分析下列两则材料,然后解答相应的试题:
材料一 ①PbO+CPb+CO↑;
②PbO+COPb+CO2;
③[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3]Ac·CO。
材料二 NH4NO2不稳定,受热分解产生氮气。
实验目的:探究PbO中含有氧。
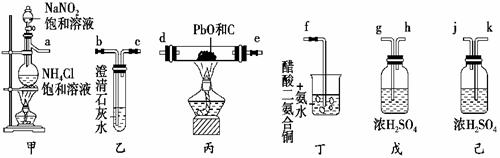
(1)写出装置甲中生成氮气的化学方程式:____________________________________。
( ) ( )→( ) ( )→( ) ( )→( ) ( )→(f)。
(3)在开始阶段,乙中的澄清石灰水中只有气泡,没有白色浑浊出现,产生这种现象的原因是 ____________________________________________ 。
(4)烧杯中醋酸二氨合铜[Cu(NH3)2]Ac的作用是 ______________________________。
(5)有同学认为该实验用干燥的空气可以代替干燥氮气。你认为这种想法是否可行?
说明理由: ___________________________________________________________。
解析:该实验的目的是测定PbO中是否含有氧。测定的方法是在加热的条件下使碳夺取PbO中的氧,然后用澄清石灰水检验产物中有CO2存在。(1)装置甲中发生两个反应,一个是氯化铵与亚硝酸钠的复分解反应,生成亚硝酸铵,另一个是加热条件下亚硝酸铵分解产生氮气的反应。(2)整套装置是先制备氮气,然后干燥,再在加热的条件下C与PbO反应,反应产物二氧化碳用澄清的石灰水检验,最后是除去混合气体中的有害气体CO的装置。(3)由于开始反应时产物中CO的量较多,而CO2较少,所以开始一段时间在澄清石灰水中并没有浑浊现象产生,随着反应的进行,反应以生成CO2为主时,才能出现浑浊。(4)从已知的化学方程式可知醋酸二氨合铜能够吸收CO,故其作用是防止CO逸出造成毒害。(5)在反应体系中通入干燥氮气的目的是防止空气中的氧气影响实验结果。若用干燥的空气代替干燥的氮气,则空气中的氧气与碳反应生成二氧化碳,不能说明二氧化碳中的氧来自PbO。
误区警示:考查装置连接顺序的题是一种老题型,如果不熟悉装置每个“部件”的作用,则会导致连接失误;注意某些装置的两个管口具有不对称性,这种装置的连接很容易将顺序连接颠倒,如该题的装置乙、戊、己。
答案:(1)NH4Cl+NaNO2NaCl+NH4NO2;NH4NO22H2O+N2↑或者NH4Cl+NaNO2NaCl+2H2O+N2↑ (2)g h(或k j) d e(或e d) b c (3)反应开始的主要产物是CO,而不是CO2 (4)吸收CO气体,防止CO逸出造成毒害 (5)不可行,因为空气中的氧气与碳反应也产生二氧化碳,导致无法确定二氧化碳中的氧到底是来自PbO还是空气
3.(2010·济南一中1月考题)将m g氨通过氨氧化法完全制成硝酸,且将硝酸全部溶解在反应中生成的水里,制成浓硝酸,其质量分数是 ( )
A.77.8% B.50% C.63.5 D.98%
解析:据4NH3+5O2催化剂△4NO+6H2O,①,
4NO+3O2+2H2O===4HNO3,②
①+②得NH3+2O2===HNO3+H2O,所以相当于1 mol水中溶解1 mol HNO3,其质量分数是×100%=77.8%。
答案:A
2.(2010·青岛二中月考题)铜能够溶解于稀硫酸与硝酸钠的混合溶液中。在烧瓶中加入体积为30 mL浓度为2 mol·L-1的硫酸和1.7 g硝酸钠固体粉末,振荡、溶解。试计算该混合溶液最多可溶解铜的物质的量为 ( )
A.0.045 mol B.0.03 mol C.0.022 5 mol D.0 mol
解析:反应的离子方程式为:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O。根据数据得知:n(H+)=2×2 mol/L×0.03 L=0.12 mol,n(NO3-)=1.7 g/85 g·mol-1=0.02 mol。比较可知H+过量,故按NO3-的量计算,得出n(Cu2+)=0.03 mol。
答案:B
1.(2010·北京-黄冈预测卷四)X微粒与水有下列反应,则X微粒是 ( )
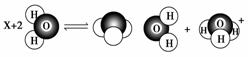
A.Cl- B.NH3 C.HCO3- D.NH4+
解析:根据示意图可知,X+2H2O NH3·H2O+H3O+,显然X为NH4+。
NH3·H2O+H3O+,显然X为NH4+。
答案:D
0.(2)pH=1
(3)72 g
0.1 mol/L。阳极得到336 mL气体中,含0.01 mol Cl2和0.005 mol O2,转移电
子的物质的量为:0.01 mol×2+0.005 mol×4=0.04 mol。
此过程中阴极刚好析出全部铜:
n(CuSO4)=n(Cu)==0.02 mol,
则c(CuSO4)==0.1 mol/L。
(2)t2时溶液中c(Na+)=0.1 mol/L,c(SO42-)=0.1 mol/L。
根据电荷守恒有:c(H+)=2×0.1 mol/L-0.1 mol/L=0.1 mol/L,即溶液的pH=1。
答案:(1)c(NaCl)=0.1 mol/L、c(CuSO4)=0.1 mol/L
15.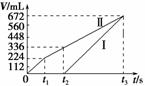 (2010·黄冈模拟)常温下电解200 mL一定浓度的
(2010·黄冈模拟)常温下电解200 mL一定浓度的
NaCl与CuSO4混合溶液,理论上两极所得气体的体积
随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成
标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液中NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
解析:(1)阳极首先逸出的是氯气:n(NaCl)=2n(Cl2)=0.02 mol,则c(NaCl)=
14.如下图,通电5 min后,电极5质量增加2.16 g,回答:
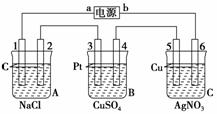
(1)电源:a是________极,b是________极;A池电极反应,电极1:__________;
电极2:____________________________________________________________。
C池电极反应,电极5:________________________________________________;
电极6:______________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过
程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为________。
解析:(1)因C池中电极5质量增加,说明电极5为阴极,Ag+得电子;电极6为
阳极,又为Cu电极,故Cu失电子。电源a极为负极,b极为正极,A池中电极
1为阴极,H+得电子,电极2为阳极,且为惰性电极,故Cl-失去电子。
(2)流经电路的电子的物质的量为:
=0.02 mol,若B池中CuSO4足量,其电极反应方程式为:
2CuSO4+2H2O4e-2Cu+O2↑+2H2SO4
可知每转移0.02 mol电子,生成O2标准状况下的体积为:
mol×22.4 L·mol-1=0.112 L=112 mL,而实得气体224 mL,说明B池中
CuSO4不足,电极3上除生成Cu外,还有112 mL H2生成,根据电子得失守恒
关系列式如下:
n(Cu)×2+×2=0.02 mol
n(Cu)=0.005 mol,
c(CuSO4)==0.025 mol/L。
答案:(1)负 正 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2Ag++2e-===2Ag
Cu-2e-===Cu2+
(2)0.025 mol/L
13.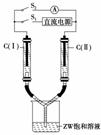 (2010·敦煌期末)X、Y、Z、W为按原子序数由小到大
(2010·敦煌期末)X、Y、Z、W为按原子序数由小到大
排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y、X2Y2、XW等
共价化合物;②Z可分别与Y、W形成Z2Y、Z2Y2、
ZW等离子化合物。
请回答:
(1)Z2Y的化学式是________。
(2)Z2Y2与X2Y反应的化学方程式______________________。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)
为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中
液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极
名称是________(填“正极”或“负极”),C(Ⅱ)的电极反应式是______________。
(4)铜屑放入稀H2SO4中不发生反应,若在稀H2SO4中放入X2Y2,铜屑逐渐溶解,
该反应的离子方程式是__________________________________________________。
解析:由X、Y、Z、W为原子序数由小到大的四种短周期元素和①②知,X为H,
Y为O,Z为Na,W为Cl。则Z2Y为Na2O,Z2Y2与X2Y的反应方程式为
2Na2O2+2H2O===4NaOH+O2↑;接通S1后电解饱和NaCl溶液,C(Ⅰ)附近变红
说明发生反应2H++2e-===H2↑,c(OH-)增大。而C(Ⅱ)极应为2Cl--2e-===Cl2↑。当断开S1接通S2后,构成了由H2和Cl2及溶液形成的原电池,H2失电子为负极,
Cl2所在极C(Ⅱ)为正极,电极式为Cl2+2e-===2Cl-;铜屑与稀H2SO4不反应,加
入X2Y2,即H2O2后由于H2O2具有强氧化性,所以铜屑溶解。
答案:(1)Na2O
(2)2Na2O2+2H2O===4NaOH+O2↑
(3)负极 Cl2+2e-===2Cl-
(4)Cu+H2O2+2H+===Cu2++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com