
题目列表(包括答案和解析)
8.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.5 mL 0.02 mol/L的高锰酸钾酸性溶液完全反应,[已知:FeSO4+KMnO4+H2SO4―→Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平)],则在上述反应中,羟胺的氧化产物是( )
A.N2 B.NO C.NO2 D.N2O
解析:设NH2OH氧化后N元素的化合价为+n,由于KMnO4―→MnSO4 ,Mn元素从+7价降为+2价,NH2OH中N元素显-1价,根据得失电子守恒有:
7.(2010·模拟题)Cu2S可与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实验参加反应的Cu2S和HNO3的物质的量之比为( )
A.1∶7 B.1∶9 C.1∶5 D.2∶9
解析:由题意,可得出Cu2S与HNO3反应的化学方程式为:2Cu2S+14HNO3===2Cu(NO3)2+2CuSO4+5NO2↑+5NO↑+7H2O。
答案:A
6.已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在Ag+催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。下列说法正确的是( )
A.反应中有水参加反应 B.反应后溶液呈无色
C.该反应的还原剂为K2S2O8 D.MnSO4和K2S2O8的化学计量数
分别为5、2
解析:由题干可知发生的反应可表示为MnSO4+K2S2O8KMnO4+K2SO4+H2SO4(反应后有H元素出现显然有H2O参加反应)。变价元素及变价情况可表示为 ―→O4-,O82-―→O42-,根据电子转移守恒,判断MnSO4和K2S2O8物质的量之比为2∶5。
答案:A
5.(2010·改编题)已知2FeCl3+2KI===2FeCl2+2KCl+I2,H2S+I2===2HI+下列叙述正确的是( )
A.氧化性:Fe3+>I2>S B.氧化性:I2>S>Fe3+
C.还原性;H2S>I->Fe2+ D.还原性:Fe2+>H2S>I-
解析:根据氧化剂的氧化性比氧化产物的强,还原剂的还原性比还原产物的强,由第1个反应可判断氧化性Fe3+>I2,还原性I->Fe2+;由第2个反应可判断氧化性I2>S,还原性H2S>I-。综合分析可知A、C两项正确。
答案:AC
4.(2010·改编题)下列试剂的浓溶液在空气中久置都会变质。在变化过程中既发生了氧化还原反应,又发生了非氧化还原反应的是( )
A.氢氧化钠 B.硫化氢 C.次氯酸钙 D.亚硫酸氢钠
解析:A项中NaOHCO2,Na2CO3,只发生非氧化还原反应。B项中H2SO2,S(H2O),只发生氧化还原反应;C项中,Ca(ClO)2CO2+H2O,CaCO3+2HClO,2HClO―→HCl+O2,既发生了非氧化还原反应,又发生了氧化还原反应;D项中NaHSO3被氧化为NaHSO4,只发生氧化还原反应。
答案:C
3.(2010·湖北黄冈中学月考)下列反应中,氧化剂与还原剂的物质的量之比为1∶2的是( )
①O3+2KI+H2O===2KOH+I2+O2 ②SiO2+2CSi+2CO↑ ③SiO2+3CSiC+2CO↑ ④4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
A.仅有② B.仅有②④ C.仅有②③④ D.①②③④
解析:
|
|
① |
② |
③ |
④ |
|
氧化剂 |
O3 |
SiO2 |
C |
MnO2 |
|
还原剂 |
KI |
C |
C |
HCl |
|
物质的量之比 |
1∶2 |
1∶2 |
1∶2 |
1∶2 |
答案:D
2.(2010·改编题)中学化学中有一类物质其氧化性强弱与物质的浓度有关,溶液的浓度不同时反应产物不相同。下列各组物质中具备上述性质的是( )
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Al与
NaOH溶液
A.①② B.①③ C.②③ D.①③④
NO2,稀HNO3→NO2,稀HNO3→NO;③稀H2SO4→H2,浓H2SO4→SO2。
答案:B
1.(原创题)某单质X在一定条件下能从含元素Y的化合物中置换出Y单质,由此可得( )
A.当X、Y均为金属时,X一定比Y活泼
B.当X、Y均为非金属时,X一定比Y活泼
C.当X是金属时,Y一定是金属
D.当X是非金属时,Y可能是金属,也可能是非金属
解析:钠在高温下与氯化钾反应置换出钾,但钠活泼性不如钾,A项错;碘与氯酸钾在一定条件下可发生反应:I2+2KClO32KIO3+Cl2,可见B项错;由2Mg+CO22MgO+C,判断C项错;根据C+CuOCu+CO和2C+SiO22CO↑+Si判断D项正确。
答案:D
15.(2009·山师附中5月考题)实验室常用30%(质量分数)的H2O2溶液快速制取少量O2,
可采用如下图所示装置。试回答:
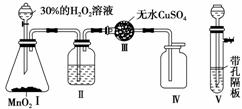
(1)MnO2的作用是
_______________________________________________________________________。
(2)反应的化学方程式为
_______________________________________________________________________。
(3)在实验过程中,除去Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中的空气的操作是:
_______________________________________________________________________。
(4)若要在Ⅳ装置中收集的气体为干燥的O2,则Ⅱ装置中应盛________(填药品名
称),通过
_______________________________________________________________________
的现象可确定Ⅳ装置中为干燥的O2。
(5)图中Ⅰ装置能否用Ⅴ装置代替?________(填“能”或“否”),其理由是
_______________________________________________________________________
_______________________________________________________________________。
解析:实验目的是制取少量O2,实验原理是用MnO2催化H2O2分解。注意基本实验
操作的规范性。
答案:(1)作催化剂 (2)2H2O22H2O+O2↑
(3)待Ⅰ装置中反应进行一会儿之后再收集氧气
(4)浓H2SO4 Ⅲ装置中无水CuSO4不变蓝
(5)否 因为MnO2为粉末状固体,遇H2O2后从隔板的孔中落入到试管底部,此时反
应速率将无法控制,导致试管内压强剧增,大量液体将从漏斗中压出
14.(2010·模拟题)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的
条件及生成的H2O已略去),已知(a)A、B、C、D是非金属单质,其中B、C、D在
常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸
雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH
溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
(1)反应③的化学方程式
_______________________________________________________________________。
(2)C的结构式________;H的化学式
_______________________________________________________________________。
(3)L的溶液与化合物E反应的离子方程式________________________。
(4)化合物J的化学式________。
解析:突破口在于C、D常温常压下为气态的非金属单质、反应②是化工生产中重要
的反应,符合这两个条件的是H2和Cl2,N2和H2,K为常用的氮肥,则F为NH3;
E为造成酸雨的污染物,可由常温常压下非气体的非金属A和气体B制得,故为SO2,
H即为NH4HSO3或(NH4)2SO3。由Cl2与NaOH制得的漂白性物质L为NaClO,它与
NH3反应生成J,J又可与O2生成C等信息,可知构成J化合物的元素是N和H,式
量为32的必为N2H4,则C为N2。根据氧化还原的原理可写出方程式。A为S,B
为O2,C为N2,D为H2,E为SO2,F为NH3,L为NaClO,H为NH4HSO3或(NH4)2SO3,
I为NaCl,J为N2H4,K为(NH4)2SO4。
答案:(1)2NH3+H2SO4===(NH4)2SO4
(2)NN (NH4)2SO3或NH4HSO3
(3)ClO-+SO2+2OH-===Cl-+SO42-+H2O
(4)N2H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com