
题目列表(包括答案和解析)
8.(2010·模拟题)某结晶水合物的化学式为R·nH2O,其相对分子质量为M,25℃时将a g该晶体溶于b g水中达到饱和,并变成V mL溶液,下列表达式中正确的是( )
A.饱和溶液的物质的量浓度为1 000a(M-18n)/MV mol·L-1
B.饱和溶液的溶质的质量分数为a(M-18n)/100M(a+b)
C.25℃时R的溶解度为100a(M-18n)/(18na+Mb)g
D.饱和溶液的密度为a(M-18n)/(a+b) g·L-1
解析:依据题示数据知:
c== mol·L-1,w==,=,则S= g,ρ== g·mL-1。
答案:C
7.(2010·郑州11中期中考题)现有t℃时质量分数为a%的KNO3溶液m g,将其分成质量比为1∶2的甲、乙两份溶液。甲溶液蒸发5 g水,恢复到原温度时析出晶体2 g;乙溶液蒸发12 g水,恢复到原温度时析出晶体5 g。则下列说法正确的是( )
A.t℃时,KNO3溶解度为41.7 g
B.t℃时,KNO3溶解度为40 g
C.t℃时,原KNO3溶液中溶质质量分数为
D.t℃时,原KNO3溶液中溶质质量分数为
解析:由题知甲的质量为m/3,乙的质量为2m/3。乙可看作两份甲,说明每蒸发6 g水,析出晶体2.5 g,而甲蒸发5 g水析出晶体2 g,说明1 g水中溶解0.5 g晶体,KNO3的溶解度为50 g;由题意结合溶解度计算得=,解得a%=。
答案:D
6.(高考题改编)标准状况下将V L(摩尔质量为M g·mol-1)气体A溶于100 mL水中,得到的溶液的密度是d g·mL-1,则此溶液物质的量浓度是( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
解析:由于题中给出溶液的密度,可根据公式c=求解。溶质的质量是(g),溶液的质量是(g),质量分数是:×100%=
×100%,把它代入公式就可得到 mol·L-1。
答案:C
5.(2010·模拟题)下图分别表示四种操作,其中有两处错误的是( )
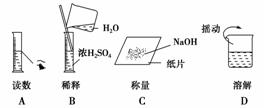
解析:A项有1处错误;B项有2处(不能在量筒中稀释浓硫酸,不能将水加入浓硫酸中);C项有1处;D项,应用玻璃棒搅拌。
答案:B
4.(2010·模拟题)在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。则该硫酸盐的物质的量浓度为( )
A.2 mol·L-1 B.2.5 mol·L-1 C.5 mol·L-1 D.7.5 mol·L-1
解析:由硫酸根离子与金属阳离子的数目之比为3∶2可知该硫酸盐的物质的量为0.5 mol,故其浓度为2.5 mol·L-1。
答案:B
3.(2010·南京一中期中考题)下列实验基本操作中正确的是( )
A.用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平
B.稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的量筒中并搅拌
C.用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁
D.用托盘天平称量物质时,称量物放在右盘,砝码放在左盘
解析:本题考查实验基本操作,较易题。稀释浓硫酸应在烧杯中进行,选项B错。用胶头滴管向试管中加液体时,胶头滴管应在试管口正上方,选项C错。用托盘天平称量物质时,称量物应放在左盘,砝码放在右盘,选项D错。
答案:A
2.(2010·模拟题)20 ℃时,饱和KCl溶液的密度为1.174 g/cm3,物质的量浓度为4.0 mol/L,则下列说法中不正确的是( )
A.25 ℃时,饱和KCl溶液的浓度大于4.0 mol/L
B.此溶液中KCl的质量分数为×100%
C.20 ℃时,密度小于1.174 g/cm3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/cm3
解析:w(KCl·20℃)=×100%,温度越高,S越大,c越大,ρ越大⇒A、B、C均正确。D项,变化后的是该温度下的饱和溶液,溶液组成未变。
答案:D
1.(2010·改编题)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液每毫升质量为q g,物质的量浓度为c mol/L。则溶质的相对分子质量为( )
A. B. C. D.
解析:(ma+nb)g=×10-3 L·c mol·L-1×M⇒M= g·mol-1⇒C项正确。
答案:C
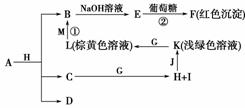
5.(2009×浙江理综,26)各物质之间的转化关系如上图,部分生成物省略。C、D是由X、Y、Z
中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最
小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、
M为金属,I有漂白作用,反应①常用于制作印刷电路板。
请回答下列问题:
(1)写出A的化学式________,C的电子式________。
(2)比较Y与Z的原子半径大小________>________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)____________________,举出该反应
的一个应用实例____________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:
________________________________________________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为
正四面体,请写出N及其2种同素异形体的名称________、________、________。
审题视点:根据X、Y、Z原子结构特征判断X为H元素,结合各物质的性质推断出X、Y、
Z及各物质。
思路详细:据题意,首先推出X为H,G为Cl2,反应①为2FeCl3+Cu===2FeCl2+CuCl2,即
M为Cu,L为FeCl3,K为FeCl2,由转化关系可知,FeCl2由H与一金属反应得到,结合J
为金属可知,J为Fe,H为HCl,I有漂白作用为HClO,则C为H2O,O最外层电子数为6,
另一元素原子最外层电子数为4,因为X、Y、Z的原子序数依次增大,所以Y为C,Z为
O。B→E→F这条线根据现象及葡萄糖参与反应可知F为Cu2O,E为Cu(OH)2,B为CuCl2,
即A与HCl反应
得CuCl2、H2O、CO2,所以A为CuCO3或碱式碳酸铜。(1)注意要求写A的化学式、水的
电子式。(2)C与O属同周期元素,从左到右,原子半径随原子序数递增而减小。(3)葡萄糖
是多羟基醛,与新制Cu(OH)2发生反应。方程式也可写为
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH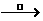 CH2OH(CHOH)4COONa+Cu2O↓+3H2O,实
CH2OH(CHOH)4COONa+Cu2O↓+3H2O,实
例可举医学上检验病人是否患糖尿病。(4)Cu2O与HNO3反应被氧化成Cu2+,同时生成无色
气体NO,注意书写化学方程式后配平。(5)CO2被还原为C,据题意可知晶体N为金刚石,
再写出其同素异形体。
规范解答:(1)Cu2(OH)2CO3[Cu(OH)2×CuCO3]或CuCO3 H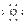 H (2)C O
H (2)C O
(3)CH2OH(CHOH)4CHO+2Cu(OH)2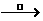 CH2OH(CHOH)4COOH+Cu2O↓+2H2O 医学上可
CH2OH(CHOH)4COOH+Cu2O↓+2H2O 医学上可
用这个反应检验尿液中的葡萄糖 (4)3Cu2O+14HNO3(稀)===6Cu(NO3)2+2NO↑+7H2O (5)
金刚石 石墨 富勒烯(C60)或碳纳米管等
4.(2010×北京-黄冈预测卷三)A、B、C、D、E五种短周期元素的原子序数依次增大。元素A
的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2
倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,
元素E与元素B可形成具有正四面体结构的物质。请回答下列问题。
(1)在周期表中,元素B位于________周期________族;A与C形成的离子化合物的电子式
为____________;A与C形成的离子化合物与水反应的化学方程式为
________________________________________________________________________。
(2)C、E形成的简单离子的离子半径大小关系为____________(用离子符号表示)。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程
式:________________________________________________________________________
________________________________________________________________________。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式:
________________________________________________________________________。
解析:由元素A的负一价离子具有和稀有气体He一样的结构推知A为H元素;由B元素的最外层电子数是内层电子总数的2倍推知B为C元素;由元素C是短周期元素中原子半径最大的主族元素,推断C为Na元素;由原子序数依次增大,得出D、E均为第三周期元素,又由于D在地壳中的含量位于第二位,推断D为Si元素;由元素E与元素B可形成具有正四面体结构的物质,推断E为Cl元素。
技巧点拨:掌握元素周期律的基本内容是进行元素推断的重要保证。本题在解题时要根据
题给信息并结合元素周期律的知识进行推断。“位、构、性”是推断的重要法宝,严格审
题是正确解决问题的途径。掌握短周期元素的特殊性是解题的突破口,如常温下的气态单
质有:H2、N2、O2、F2、Cl2;形成化合物种类最多的元素是C;最高价氧化物对应水化物
酸性最强的元素是Cl等。
 答案:(1)第二 第ⅣA Na+[:H]- NaH+H2O===NaOH+H2↑ (2)r(Cl-)>r(Na+)
答案:(1)第二 第ⅣA Na+[:H]- NaH+H2O===NaOH+H2↑ (2)r(Cl-)>r(Na+)
(3)SiCl4+3H2O===H2SiO3↓+4HCl↑ (4)C+H2O(g) CO+H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com