
题目列表(包括答案和解析)
5.(2010·华南师大附中月考题)氮化硅的硬度大、熔点高,化学性质稳定、抗腐蚀能力强,还能抗冷热冲击。工业上可用高纯硅与纯氮气在高温下反应制取。
(1)根据氮化硅的性质,推测其用途是 ( )
A.制造永久性模具 B.制汽轮机叶片
C.制有色玻璃 D.制造柴油机
(2)根据氮和硅在周期表中的位置,写出氮化硅的化学式________。
(3)氮化硅可被氢氟酸腐蚀,生成四氟化硅和氨。写出反应的化学方程式_______ _________________________________________________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下加强热发生反应,可得到较高纯度的氮化硅。写出反应的化学方程式为________________________________________ ________________________________。
解析:N元素非金属性比Si强,N显-3价、Si显+4价,所以氮化硅的化学式为Si3N4;由于Si与F有极强的亲合性,生成了SiF4而使Si3N4被HF腐蚀;利用SiCl4、N2、H2反应制Si3N4可理解为H2还原SiCl4生成Si,Si在高温下与N2化合生成Si3N4。
答案:(1)ABD
(2)Si3N4
(3)Si3N4+12HF===3SiF4↑+4NH3↑
(4)3SiCl4+2N2+6H2Si3N4+12HCl
4.(2010·菏泽一中1月考题)下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。请回答下列问题:
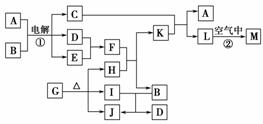
(1)基于反应①的化学工业称为________,写出该反应的化学方程式:_________ _______________________________________________________________。
(2)写出K和E反应的离子方程式:_____________________________ ___________________________________________,
写出F溶液和H反应的离子方程式:__________________________ ______________________________________________。
(3)已知:由1 mol G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为________。
解析:突破点1:D、I是水煤气的主要成分且D是电解的产物之一,判断D为H2,I为CO;突破点2:“LM(红褐色)”,推断L是Fe(OH)2,M是Fe(OH)3;突破点3:B是无色液体,CO与B反应生成H2和J,可见J为CO2,B为H2O;结合其它信息推断A为NaCl,C为NaOH,H为FeO,E为Cl2,K为FeCl2,F为HCl。
答案:(1)氯碱工业 2NaCl+2H2OH2↑+Cl2↑+2NaOH
(2)2Fe2++Cl2===2Fe3++2Cl- FeO+2H+===Fe2++H2O
(3)FeC2O4
3.(2010·陕西师大附中1月考题)在一定条件下,科学家利用从烟道气中分离出的CO2
与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:ΔH1
=-725.5 kJ/mol、ΔH2=-285.8 kJ/mol,合成过程如下图所示,下列说法不正确的是( )
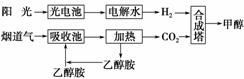
A.“阳光→电池→光电池→电解水”过程中的能量变化是光能→电能→化学能
B.该合成路线对于环境保护的价值是有利于防止温室效应
C.乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,其原因可表示为:HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
D.以CO2、H2合成CH3OH的热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l);ΔH=+131.9 kJ/mol
解析:A项正确;该过程中能将CO2吸收再利用,B项正确;胺与NH3类似,水溶液呈弱碱性,C项正确;ΔH=反应物燃烧热总和-生成物燃烧热总和=0+(-285.8×3)-(-725.5)+0=-131.9(kJ/mol)[注意CO2(g)、H2O(l)都为稳定的氧化物,燃烧热都为0],D项不正确。
答案:D
2.(2010·北京-黄冈预测卷四)下列关于硅单质及其化合物的说法正确的是 ( )
①氮化硅陶瓷是新型无机非金属材料 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④玻璃的主要成分可表示为Na2O·CaO·6SiO2,则其为氧化物制品
A.① B.②③ C.①④ D.③④
解析:水晶的主要成分是SiO2,而非硅酸盐制品,②错;光导纤维的主要成分是SiO2,而非单质Si,③错;玻璃的主要成分虽可用Na2O·CaO·6SiO2表示,但这仅仅是以氧化物的形式表示,它仍属于硅酸盐制品,④错。
答案:A
1.(2010·山西师大附中1月考题)中国网通集团在原有EAC网络的基础上,建造了一条
约350公里长的海底光缆,在2008年北京奥运会中担当重要通信任务。下列关于通
信光缆成分的说法中不正确的是 ( )
A.光导纤维的主要成分为SiO2
B.硅为亲氧元素,在自然界中都以化合态形式存在
C.SiO2熔点高,硬度大,其结构中最小的环为12元环
D.科学家提出硅将作为21世纪一种普遍使用的新型能源被开发利用,寻找高效催化剂使SiO2分解同时释放能量,是硅能源大规模利用的关键
解析:硅发生氧化反应生成SiO2要放出大量的热,则SiO2分解需要吸收大量的热,催化剂不能改变反应热,所以D项说法错误。C项中,由于金刚石的最小碳环为6元环,用硅原子代替金刚石中的碳原子,在每个硅原子间再“插入”一个氧原子,所以SiO2晶体中最小环是12元环。
答案:D
15.充分燃烧某糖,消耗的氧气、生成的CO2和H2O的物质的量都相等,它的相对分子质量是它的最简式的5倍,0.1 mol该糖能与24 g乙酸发生酯化反应,且该糖能与银氨溶液发生银镜反应。求:
(1)该糖的最简式;
(2)该糖的相对分子质量、分子式;
(3)若该糖是直链分子,同一个碳原子上连有2个羟基不稳定,推导出它的结构简式。
解析:(1)设该糖的最简式为CxHyOz,则
CxHyOz+O2xCO2+H2O,
即 x+-=x=。
解得x∶y∶z=1∶2∶1,所以该糖的最简式为CH2O。
(2)因相对分子质量是最简式的5倍,所以相对分子质量为:30×5=150,分子式为C5H10O5。
(3)24 g乙酸的物质的量为=0.4 mol。
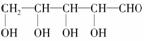 即1 mol该糖能与4 mol乙酸发生酯化反应,亦即1分子中含有4个醇羟基;又因该糖能发生银镜反应,故分子中应含有-CHO;该糖是直链分子,且羟基连在不同的碳原子上,所以该糖的结构简式为:
即1 mol该糖能与4 mol乙酸发生酯化反应,亦即1分子中含有4个醇羟基;又因该糖能发生银镜反应,故分子中应含有-CHO;该糖是直链分子,且羟基连在不同的碳原子上,所以该糖的结构简式为:
14.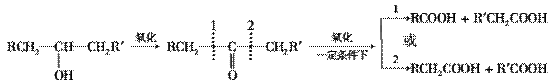 葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。
葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。
已知:将A进行如下图所示的反应,其中C和C′是同系物,C′是甲酸。
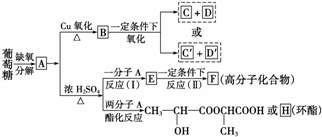
回答下列问题:
(1)C和D′属于________(填序号,下同)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
E的化学方程式__________________________________________________________;
(2)D′和E分别属于哪一类化合物:D′________,E________________。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A______________,F____________,H________________。
(4)写出反应类型:(Ⅰ)________,(Ⅱ)________。
(5)写出A―→E的化学方程式__________________________________________。

13.随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来理想的燃料是绿色植物,即将植物的秸杆(主要成分是纤维素)用适当的催化剂作用水解成葡萄糖,再将葡萄糖转化为乙醇,用作燃料。
(1)写出绿色植物秸杆转化为乙醇的化学方程式:
①_______________________________________________________________________,
②_______________________________________________________________________。
(2)乙醇除用作燃料外,还可以用它合成其他有机物。下列主要是以乙醇为起始原料的转化关系图:

试写出上图中A、B的结构简式:A______________,B______________。
(3)写出上述转化关系图中A+B―→C4H4O4的化学方程式(有机物用结构简式表示):________________________________________________________________________
________________________________________________________________________。
解析:糖类由于它与日常生活、生物学科知识的密切联系而变得重要起来。因此它是新的高考热点,在主要的性质、重要用途及日常生活问题上应给予关注。要制C4H4O4环状酯,必须通过乙二醇和乙二酸发生酯化反应制得。
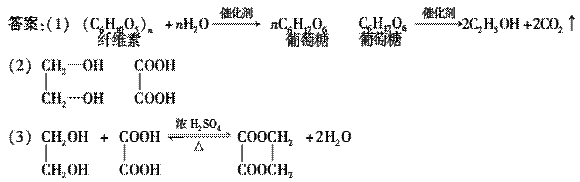
12.某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗进行综合利用不仅可以提高经济效益,而且还能防止环境污染,现按以下方式进行:
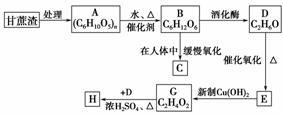
已知H是具有香味的液体,试填空:
(1)A的名称________;H的名称________;
(2)D→E的化学方程式_________________________________________________;
(3)G→H的化学方程式________________________________________________;
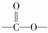 (4)H含有“ ”结构链状的同分异构体最多有________种。写出H属于不同种
(4)H含有“ ”结构链状的同分异构体最多有________种。写出H属于不同种
类的任意两种同分异构体的结构简式________、________。
 解析:甘蔗渣的主要成分是纤维素,其水解生成葡萄糖,葡萄糖被氧化为乙醇,乙醇被氧化为乙醛,在不熟悉乙醛的性质时,可联系到葡萄糖的性质,因含有 ,故能被新制Cu(OH)2氧化为乙酸,然后结合题目解答。
解析:甘蔗渣的主要成分是纤维素,其水解生成葡萄糖,葡萄糖被氧化为乙醇,乙醇被氧化为乙醛,在不熟悉乙醛的性质时,可联系到葡萄糖的性质,因含有 ,故能被新制Cu(OH)2氧化为乙酸,然后结合题目解答。
答案:(1)纤维素 乙酸乙酯
(2)2CH3CH2OH+O2催化剂△2CH3CHO+2H2O
 (3)CH3CH2OH+CH3COOH浓硫酸△CH3COOCH2CH3+H2O
(3)CH3CH2OH+CH3COOH浓硫酸△CH3COOCH2CH3+H2O
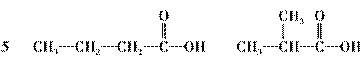
(4)
11.(2008·西昌质检)如图所示:
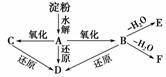
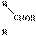 淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得五元环的酯类化合物E或六元环的酯类化合物F。已知:相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之, 最难。
淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得五元环的酯类化合物E或六元环的酯类化合物F。已知:相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之, 最难。
请在下列空格中填写A、B、C、D、E、F的结构简式。
A__________________;B__________________;C__________________;D__________________;E__________________;F__________________。
 解析:首先根据A是淀粉的水解产物及A的氧化产物B、C可确定A为葡萄糖。葡萄糖分子结构中有三种结构单元:一个-CHO、一个-CH2OH和四个 ,根据题给信息,-CHO最易被氧化,且B的分子组成(C6H12O7)只比CH2OH(CHOH)4CHO多一个O,
解析:首先根据A是淀粉的水解产物及A的氧化产物B、C可确定A为葡萄糖。葡萄糖分子结构中有三种结构单元:一个-CHO、一个-CH2OH和四个 ,根据题给信息,-CHO最易被氧化,且B的分子组成(C6H12O7)只比CH2OH(CHOH)4CHO多一个O,
所以B是CH2OH(CHOH)4CHO中-CHO被氧化为-COOH的产物,
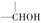 B的结构简式为:CH2OH(CHOH)4COOH。由C的分子组成比葡萄糖多两个O,少两个H可判断除醛基外还有一个醇羟基被氧化,根据题给信息,-CH2OH比 容易被氧化,所以是-CH2OH被氧化为-COOH,C的结构简式为:HOOC(CHOH)4COOH。由D的分子组成可判断,D是CH2OH(CHOH)4CHO中-CHO被还原为-CH2OH的产物,D的结构简式为:CH2OH(CHOH)4CH2OH。B中既有-COOH又有-OH,可以发生分子内酯化反应,生成环状化合物,但-COOH与不同的C上的-OH反应形成的环的大小是不同的,根据E、F是五元环和六元环的酯,可确定E、F分别是-COOH与4、5位C上-OH酯化的产物(以-COOH上C为1位C)。
B的结构简式为:CH2OH(CHOH)4COOH。由C的分子组成比葡萄糖多两个O,少两个H可判断除醛基外还有一个醇羟基被氧化,根据题给信息,-CH2OH比 容易被氧化,所以是-CH2OH被氧化为-COOH,C的结构简式为:HOOC(CHOH)4COOH。由D的分子组成可判断,D是CH2OH(CHOH)4CHO中-CHO被还原为-CH2OH的产物,D的结构简式为:CH2OH(CHOH)4CH2OH。B中既有-COOH又有-OH,可以发生分子内酯化反应,生成环状化合物,但-COOH与不同的C上的-OH反应形成的环的大小是不同的,根据E、F是五元环和六元环的酯,可确定E、F分别是-COOH与4、5位C上-OH酯化的产物(以-COOH上C为1位C)。
答案:A.CH2OH(CHOH)4CHO
B.CH2OH(CHOH)4COOH
C.HOOC(CHOH)4COOH
D.CH2OH(CHOH)4CH2OH
E.CH2OHCHOHHOOHOO
F.OHOHOOCH2OHHO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com