
题目列表(包括答案和解析)
8.(2009·广东理基)下列说法正确的是 ( )
A.向0.1 mol·L-1Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
解析:本题考查电解质溶液的相关知识。Na2CO3水解显碱性,使酚酞变红,A对;
pH=2的溶液是酸性溶液,与CO32-不共存,B错;乙醇是非电解质,C错;由于
H2SO4是二元酸,HCl为一元酸,等物质的量的HCl和H2SO4消耗NaOH的物质
的量不同;D错。
答案:A
7.(2009·杭州质量检测)25℃在某物质的溶液中,由水电离出的H+浓度为1×
10-a mol/L,下列说法不正确的是 ( )
A.a<7时,水的电离受到促进 B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH可能为a D.a>7时,溶液的pH一定为14-a
答案:D
6.(2010·启东期末)室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同
学计算出由水电离出的c(OH-)的数据分别为:甲:1.0×10-7 mol/L;乙:1.0×
10-6 mol/L;丙:1.0×10-2 mol/L;丁:1.0×10-12 mol/L。其中你认为可能正确的
数据是 ( )
A.甲、乙 B.乙、丙 C.丙、丁 D.乙、丁
解析:如果该溶液是一种强碱(例如NaOH)溶液,则该溶液的OH-首先来自于碱
(NaOH)的电离,水的电离被抑制,c(H+)=1×10-12 mol/L,所有这些H+都来自于
水的电离,水电离时当然同时提供相同物质的量的OH-,所以丁是对的。如果该溶
液是一种强碱弱酸盐溶液,则该溶液之所以呈碱性是由于盐中弱酸根水解的缘故。
水解时,弱酸根离子与水反应生成弱酸和OH-,使溶液中c(OH-)>c(H+),溶液中
的OH-由水电离所得,所以丙也是正确的。
答案:C
5.(2009·宁夏)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关
量或性质的变化趋势,其中错误的是 ( )
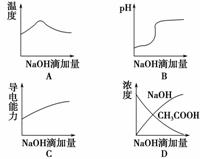
解析:中和反应为放热反应,随着NaOH溶液加入,放出热量逐渐增多,溶液温度
升高,当反应完全时,再加NaOH溶液,溶液温度又逐渐降低,A正确;随着NaOH
溶液加入,溶液由酸性逐渐到中性,又到碱性,在溶液pH约为7时出现突变,当
醋酸完全反应后,再加NaOH溶液,pH增大缓慢,所以B正确;醋酸是弱酸,加
入NaOH溶液,生成强电解质醋酸钠,溶液导电能力增强,当CH3COOH反应完全后,再继续滴加NaOH,使得溶液中离子浓度又增大,从而导电能力增强,C正确;在加入NaOH溶液,而CH3COOH有剩余时,NaOH溶液浓度为零,所以D不正确。
答案:D
4.在25℃时,向1体积pH=x的盐酸中加入10体积pH=y的氢氧化钠溶液,若所得
溶液中c(Na+)=c(Cl-),则此时(x+y)为 ( )
A.13 B.14 C.15 D.无法计算
解析:据反应后所得溶液中c(Na+)=c(Cl-),可知c(H+)=c(OH-),溶液呈中性,则: 1×10-x=10×10y-14=10y-13,即-x=y-13,得x+y=13。
答案:A
3.甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol·L-1时,甲酸中的c(H+)约为乙酸中
c(H+)的3倍。现有两种浓度不等的甲酸溶液 a和b,以及0.10 mol·L-1的乙酸,
经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
解析:本题主要考查弱电解质的电离平衡知识和酸的相对强弱等问题。由于
c(HCOOH)=c(CH3COOH)=0.10 mol·L-1时,甲酸中的c(H+)等于乙酸中c(H+)的3倍,故甲酸的酸性强于乙酸的酸性。又因pH(a)>pH(CH3COOH)>pH(b)即溶液a的c(H+)<0.10 mol·L-1 CH3COOH的c(H+)<溶液b的c(H+),所以a的浓度小于乙酸的浓度,但无法确定乙酸与b的浓度的相对大小(因HCOOH酸性>CH3COOH酸性)。
答案:A
2.90℃时水的离子积KW=3.8×10-13,该温度时纯水的pH ( )
A.等于7 B.介于6-7之间 C.大于7 D.无法确定
解析:90℃时纯水中的c(H+)= =10-7×,pH=-lg[c(H+)]=
-lg(10-7×)=7-lg,因其大于6,小于7,故选B。
答案:B
1.(2010·南菁中学)下列叙述正确的是 ( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)×c(OH-)=
1×10-14
B.c(H+)等于1×10-7 mol/L的溶液一定是中性溶液
C.0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol/L CH3COOH溶液中的c(H+)的2
倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
解析:KW=c(H+)·c(OH-),且KW只与温度有关,所以,在常温下,纯水,酸性、
碱性或中性稀溶液,其KW=1×10-14;在温度不确定时,中性溶液里的c(H+)不一
定等于1×10-7 mol/L;0.2 mol/L CH3COOH溶液中的CH3COOH电离程度比mol/
L CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol/L CH3COOH溶液中的
c(H+)小于0.1 mol/L CH3COOH溶液中的c(H+)的2倍;当c(H+)或c(OH-)大于1 mol/L
时,用pH表示溶液的酸碱性就不简便了,所以,当c(H+)或c(OH-)大于1 mol/L时,
一般不用pH表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示。
答案:A
15.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶
液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液测定未知浓度的无色NaHSO3溶液的浓
度,反应离子方程式是2MnO4-+5HSO3-+H+===2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁
架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)不用________(酸、碱)式滴定管盛放高锰酸钾溶液,试分析原因:
________________________________________________________________________。
(3)选何种指示剂,说明理由
________________________________________________________________________。
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL。则(b-a) mL
比实际消耗KMnO4溶液体积________(多、少),根据(b-a) mL计算得到的待测浓度,
比实际浓度________(大、小)。
解析:(1)因为氧化还原滴定实验类似于中和滴定,由中和滴定实验所需仪器的选用进
行迁移可得出正确答案。
(2)由于KMnO4具有强氧化性,能腐蚀橡胶管,故不能用碱式滴定管盛放KMnO4溶液。
(3)MnO4-为紫色, Mn2+为无色,可用这一明显的颜色变化来判断滴定终点。
(4)滴定后俯视液面,所读体积偏小,所测浓度比实际浓度偏小。
答案:(1)ADEFH (2)碱 高锰酸钾能腐蚀橡胶管 (3)不用指示剂,因为MnO4-―→
Mn2+时紫色褪去 (4)少 小
14.某工厂废水中含游离态氯,通过下列实验测定其浓度①取水样10.0 mL于锥形瓶,
加入10.0 mL KI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1的Na2S2O3溶液,
调整液面,记录读数。③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+
2Na2S2O3===2NaI+Na2S4O6
试回答下列问题:
(1)步骤①加入的指示剂是________。
(2)步骤②应使用________式滴定管。
(3)步骤③当待测液由________色变为________色且30 s不再变化即达终点,若耗去
Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为________________。
(4)Cl2的实际浓度比所测浓度应________(填“偏大”、“偏小”或“相等”),造成
误差的原因是____________________________________________________________
________________________________________。
解析:因为碘遇淀粉变蓝色,可用淀粉作指示剂;0.01 mol·L-1Na2S2O3溶液呈碱性,
故用碱式滴定管;废水中的氯气置换出碘单质使淀粉溶液变蓝,再用Na2S2O3还原
碘单质,溶液蓝色消失;由已知的Na2S2O3的物质的量,通过关系式:Cl2-I2-2Na2S2O3,可求出Cl2的物质的量浓度。
答案:(1)淀粉溶液 (2)碱 (3)蓝 无 0.01 mol·L-1 (4)偏小 步骤②滴定管用蒸馏
水洗净后未用标准液润洗,故测出的c(Cl2)大于实际浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com