
题目列表(包括答案和解析)
1.重要的氧化剂有①活泼的非金属单质,如Cl2、Br2 、O2等;②过氧化物,如Na2O2、H2O2等;③某些元素的氧化物、含氧酸,如MnO2 、H2SO4、HNO3 、HClO等;④高价金属的阳离子,如Fe3+、Cu2+等;⑤一些盐类,如 KmnO4、KclO3 、K2Cr2O7 。
4.氧化剂的氧化性和还原剂的还原性均随浓度的增大、温度的升高而增强。
3.具有多种可变化合价的元素,一般是处于最高价态时的氧化性最强,随着化合价的降低,其氧化性减弱,还原性增强。例如:按
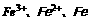 次序,其氧化性递减,而还原性递增。但Cl元素特殊, HCl0的氧化性强于HclO4。
次序,其氧化性递减,而还原性递增。但Cl元素特殊, HCl0的氧化性强于HclO4。
2.非金属性越强的元素,共单质的氧化性越强,而对应的阴离子还原性越弱;金属性越强的元素,其单质的还原性越强,而对应的阳离子氧化性越弱。例如:还原性Na>Mg>Al,氧化性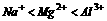 。
。
1.在“氧化剂+还原剂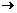 还原产物+氧化产物”的反应中,一般是:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性。
还原产物+氧化产物”的反应中,一般是:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性。
2.还原剂是指在反应中失去电子(或电子对偏离)的物质,也就是反应后所含元素化合价升高的物质。还原剂具有还原性,反应时本身被氧化,其生成物为氧化产物。可概括为“升、失、氧”。
-e-
还原剂 ⇌ 氧化剂
+e-
1.氧化剂是指在反应中得到电子(或电子对偏向)的物质,也就是反应后所含元素化合价降低的物质。氧化剂具有氧化性,反应时本身被还原,其生成物为还原产物。可概括为“降、得、还”。
25.答案:
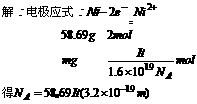
25.两根镍棒分别与电源正负极相连,并都插入NiSO4溶液中。若电流强度为J,通电时间为ts,结果阳极失重mg。已知每个电子的电量为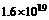 C,则可推知阿伏加德罗常数为多少?(10分)
C,则可推知阿伏加德罗常数为多少?(10分)
24.(1)当电源通过2L 6%的KOH溶液(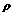 =1.05g/mL)时,溶液的浓度改变了2%,此时阳极析出的物质是什么?质量为多少克?(6分)
=1.05g/mL)时,溶液的浓度改变了2%,此时阳极析出的物质是什么?质量为多少克?(6分)
(2)若电解后溶液不小心混入KCl杂质,为了除去杂质又进行电解,当有5.6L(标况)Cl2析出,可认为电解作用是完全的,求最后所得溶液中KOH的质量分数为多少?(5分)
答案:24.(1)阳极析出的物质是O2|

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com