
题目列表(包括答案和解析)
13.工业上采用铁和石墨为电极,电解K2MnO4溶液制取KmnO4 。
(1)电解时,应以 作阴极,电解过程中,阴极附近溶液的pH将会 。(填“增大”“减小”或“不变”)
(2)阳极反应式为 .
(3)电解的总化学方程式为 。 
答案:13.(1)铁,增大
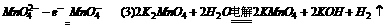
分析: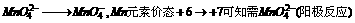 阳极必须用石墨等惰性材料作电极,否则失电子为电极材料,而不是
阳极必须用石墨等惰性材料作电极,否则失电子为电极材料,而不是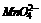 ,则阴极以铁为电极,电极反应为:
,则阴极以铁为电极,电极反应为: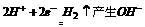
,故pH将增大;总电解反应的化学方程式在电子转移守恒的基础上将阴、阳两极反应叠加即得
12.采用惰性电极从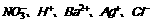 等离子中,选出适当的离子,组成电解质,对其溶液进行电解:
等离子中,选出适当的离子,组成电解质,对其溶液进行电解:
(1)两极分别放出H2和O2,电解质的化学式是 。
(2)阴极析出金属,阳极放出H2 ,电解质的化学式是 。
(3)两极分别放出气体,且体积比为1:1,电解质的化学式是 。
答案:12.(1) 分析:①两极分别放出H2和O2,则溶液中不能含有Ag+、Cl-;②阴极析出金属,说明溶液中含有Ag+,阳极放出O2,则不能含Cl-,所以该电解质应为AgNO3;③两极分别放出气体,且体积比为1:1,说明放出气体的两种粒子的离子所带电荷数和分子形式等同,只有H+、Cl-(H+放电,则肯定无Ag+,Cl-放电,无
分析:①两极分别放出H2和O2,则溶液中不能含有Ag+、Cl-;②阴极析出金属,说明溶液中含有Ag+,阳极放出O2,则不能含Cl-,所以该电解质应为AgNO3;③两极分别放出气体,且体积比为1:1,说明放出气体的两种粒子的离子所带电荷数和分子形式等同,只有H+、Cl-(H+放电,则肯定无Ag+,Cl-放电,无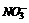 ),所以电解质组合为
),所以电解质组合为
11.用惰性电极电解Fe(SO4)3和CuSO4的混合液,且已知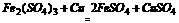 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.阴极反应式为: ,当有Cu2+存在时Fe+3+不放电
,当有Cu2+存在时Fe+3+不放电
B.阴极上首先析出铁,然后析出铜
C.首先被电解的是Fe2(SO4),溶液,后被电解的是CuS04溶液
D.阴极上不可能析出铜
答案:11.C 分析:由反应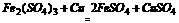 可知,氧化性:
可知,氧化性: 则Fe+得电子能力比Cu2+强,所以,在阴极首先得电子的是
则Fe+得电子能力比Cu2+强,所以,在阴极首先得电子的是 即Fe2(SO4)3;溶液先被电解,CuSO4溶液后被电解
即Fe2(SO4)3;溶液先被电解,CuSO4溶液后被电解
10.右图中X、Y分别是直流电源的两极,通电后,发现a极板质量增加,b极板处有无色无嗅气体放出,符合这一情况的是 ( )
a极板 b极板 X电极 Z溶液
A.锌 石墨 负极 CuS04
B.石墨 石墨 负极 NaOH
C.银 铁 正极 AgNO3
D.铜 石墨 负极 CuCl2
 答案:10.A
答案:10.A
9. 将物质的量浓度相等的CuSO4和NaCl两种溶液等体积混合后,用石墨电极进行电解,能正确表示溶液的pH随时间(t)变化图象的是 ( )
将物质的量浓度相等的CuSO4和NaCl两种溶液等体积混合后,用石墨电极进行电解,能正确表示溶液的pH随时间(t)变化图象的是 ( )
答案: 9,B 开始电解的是CuCl2,pH不变,继而电解的是CuaSO4,pH下降,最后电解的是Na2SO4,pH保持不变
8.电解84.75mLl6%的NaOH溶液(密度为1.18g/cm3),用石墨作电极经过一段时间后,电解质溶液浓度为19.5%,这是因为 ( )
A.溶质增加了3.5g B.放出22.4LH2和11.2L H2
C.NaOH比水消耗少 D.消耗18g水
答案: 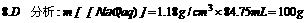
根据电解前后溶质不变,则有(设水的减少量为 xg)

7.将两个铂电极插入500mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中氢离子浓度约为 ( )

答案: 7.A 根据电解反应关系式:Cu-2H+可知,每生成64g铜将同时生成2molH+,故]

6.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列表述正确的是 ( )
A.在两个阴极上得到的银和汞的物质的量之比n(银):n(汞)=2:1
B.在两个阳极上得到的产物的物质的量不相等 ,
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg(NO3)2
答案: 6.D 因为电解AgNO3溶液,阴极反应式为Ag++e-=Ag;电解硝酸汞溶液,阴极反应式为Hg++e-=Hg。由于它们物质的量为2:1,说明
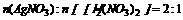
5.用惰性电极电解M(N03)。的水溶液,当阴极增重ag时,在阳极同时产生bL气体(标准状况),从而可知M的相对原子质量为( )

答案: 5.C
4.当两极都用银片作电极电解AgN03溶液时,在阳极上的产物是 ( )
A.只有银 B.银和氧气 C.只有氢气 D.上述都不对
答案: 4.D 分析:当用活性材料作电极,阳极反应应该是金属失电子,金属被溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com