
题目列表(包括答案和解析)
7.实验室测得4molSO2参加下列反应: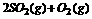 ⇌
⇌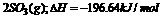 当放出314.3kI热量时,S02的转化率最接近于 ( )
当放出314.3kI热量时,S02的转化率最接近于 ( )
A.40% B.50% C.80% D.90%
答案: 7.C 分析:由反应: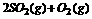 ⇌2SO3(g);△H=-196。64Kj/mol
⇌2SO3(g);△H=-196。64Kj/mol
2mol 196.64Kj
x=3.2mol 314.3Kj
则SO2的转化率为: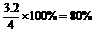
8,家用液化气中主要成分之一是丁烷。在101 kPa时,lO kg丁烷完全燃烧生成CO2和H2 O(1) (1)放出热量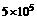 kJ,丁烷的燃烧热为 ,丁烷燃烧的热化学方程式为
。
kJ,丁烷的燃烧热为 ,丁烷燃烧的热化学方程式为
。
答案:

6.强酸和强碱的稀溶液的中和热可表示为: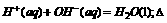 H=-57.3 kJ/mol,已知分别与l L0.1 mol/L的NaOH溶液恰好反应的下列物质:①乙酸溶液;②浓H2SO4;③稀硝酸,恰好反应后放出的热量分别为Q1 、Q2 、Q3 (单位:kJ),则Q1 、Q2 、Q3的关系正确的是 ( )
H=-57.3 kJ/mol,已知分别与l L0.1 mol/L的NaOH溶液恰好反应的下列物质:①乙酸溶液;②浓H2SO4;③稀硝酸,恰好反应后放出的热量分别为Q1 、Q2 、Q3 (单位:kJ),则Q1 、Q2 、Q3的关系正确的是 ( )

答案: 6.B ①生成CH3COONa,CH3COO-的水解要吸热,所以Q1<57.3 kJ;②l L 0.1 mol/L的NaOH溶液溶于浓H2SO4时就放热,再加上反应放出的热量,所以Q2>57.3 kJ;③Q3=57.3 kJ
5.含Ba(OH)2 1 mol的稀溶液与足量稀盐酸反应,放出114.6 kJ的热量,表示该反应中和热的热化学方程式正确的是 ( )
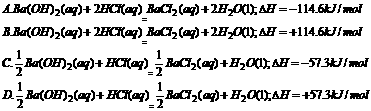
答案: 5.C 中和热是以生成1 mol水所释放的热量来定义的,因此在书写它们的热化学方程式时,应以生成1mol水为标准配平其余物质的化学计量数
4.已知: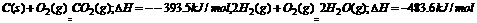 。现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为 ( )
。现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为 ( )
A.1:1 B.1:2 C.2:3 D.3:2
答案: 4.A
3.下列说法不正确的是 ( )
A.物质发生反应放出的能量才是反应热
B.热化学方程式中各物质的系数只表示物质的量而不表示分子的个数
C.化学反应除生成新物质外,还发生能量变化
D.物质燃烧总是放热反应
答案: 3.A
2.已知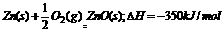 AH=-350kJ/mol,则lgZn在氧气中燃烧放出的热量约为 ( )
AH=-350kJ/mol,则lgZn在氧气中燃烧放出的热量约为 ( )
A.5.4 kJ B.350 kJ C.3.;kJ D.8.5kJ
答案: 2.A lgzn在氧气中燃烧放出的热量约为: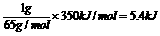
1.充分燃烧一定量的丁烷气(C4H10)放出的热量为yQ,经测定完全吸收它生成的CO2,需消耗5mol/LKOH溶液100mL恰好生成正盐,则燃烧1 mol丁烷放出的热量为 ( )
A.4yQ B.5yQ C.8yQ D.16vQ
答案:1.D
3.结合化石燃料的使用及新能源的开发课题,通过讨论或辩论的形式,加深对化学与社会联系的认识,并对煤的综合利用及新技术的开发做综合讨论。
潜能开发
[例1]下列说法中,正确的是 ( )
A.1molH2 SO4与1molBa(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101kPa时,1mol碳燃烧所放出的热量一定叫碳的燃烧热
D.CO燃烧是吸热反应
思路分析
中和热是稀溶液中酸与碱中和生成1 molH2O所放出的热量,燃烧热指1 mol可燃物完全燃烧生成稳定的氧化物所放出的热量。 1molH2S04与1molBa(OH)2完全中和要生成2molH2O,碳燃烧有完全燃烧与不完全燃烧的区别。因而A、C是错误的。中和反应和盐的水解反应互为可逆,因中和反应是放热反应,故盐类水解反应是吸热反应,B正确。
[例2](1)在101kPa时,H2在1.00molH2中完全燃烧生成 2.00molH2 O2(1)放出571.6kJ的热量,H2 的燃烧热为 ,表示H2燃烧热的热化学方程式为 。
(2)1.00L1.00mol/LH2SO4 溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为 ,表示其中和热的热化学方程式为 。
思路分析
H2 的燃烧热应以燃烧1
molH2 为标准,当H2 完全燃烧生成 2.OomolH2 O时,需燃烧2.00molH2,故H2的燃烧热为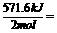 285.8 kJ/mol。中和热以生成L molH2O 为标准,而1.00 L 1.00mol/LH2SO4
溶液与2.00 L 1.00 mol/l NaOH溶液反应生成
2.molH20,故该反应的中和热为114.61d=57.3 kJ/mol。书写表示燃烧热与中和热的热化学方程式时,必须体现燃烧热与中和热的研究标准。
285.8 kJ/mol。中和热以生成L molH2O 为标准,而1.00 L 1.00mol/LH2SO4
溶液与2.00 L 1.00 mol/l NaOH溶液反应生成
2.molH20,故该反应的中和热为114.61d=57.3 kJ/mol。书写表示燃烧热与中和热的热化学方程式时,必须体现燃烧热与中和热的研究标准。
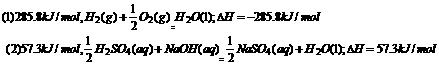
[例3]已知下列两个热化学方程式: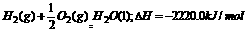 ,实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3 847kJ,则混合气体中H2和C3H8的体积比是 ;二者放出的热量之比约为
.
,实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3 847kJ,则混合气体中H2和C3H8的体积比是 ;二者放出的热量之比约为
.
思路分析
据丙烷的燃烧热和混合气燃烧放热的总值推算,混合气中丙烷的物质的量必定小于2 mol,由此可知混合气中H2和C3H8 物质的量之比大于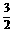 ,其体积比也大于
,其体积比也大于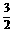 ,在所给四个选项中只有B选项符合这一要求,至于二者放出的热量之比,需根据各自的燃烧热及其物质的量进行计算确定。
,在所给四个选项中只有B选项符合这一要求,至于二者放出的热量之比,需根据各自的燃烧热及其物质的量进行计算确定。
[答案]B;D
思维诊断
据燃烧热定义,任何可燃物的燃烧反应都是放热反应,所以D错误。
[答案]B
思维诊断
此题属概念辨析问题,解题的关键是准确记忆与运用概念,如对概念的要点疏忽极易判断失误。
思维诊断
书写一般热化学方程式,只需将反应热的数值与热化学方程式中各物质的化学计量数相对应即可。书写表示燃烧热与中和热的热化学方程式时,反应热的数值应以1 mol可燃物或生成 l molH2O为标准,在此基础上确定其他物质的化学计量数。
思维诊断
计算型选择题最常用的一种解题方法是估算法,采-用此法可减少运算量,快速准确地做出结论。除此以外,平均值法、极限分析法、十字交叉法等均是巧解计算型选择题的首选方法。
知能达标训练
2.采用对比的方法,注意燃烧热和中和热的联系与区别。
|
|
研究条件 |
标准 |
能量变化 |
单位 |
注意事项 |
|
燃烧 |
101kPa |
1mol |
放热(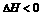 ) ) |
kJ/mol |
可燃物要完全燃烧,生成稳定的氧化物 |
|
中和热 |
稀溶液 |
生成1mol |
放热(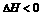 ) ) |
kJ/mol |
强酸与强大事碱在稀溶液中反应生成1mol 水,都放出57.3kJ热 |
1.燃烧热和中和热是反应热的两种类型,学习时应将其与热化学方程式联系起棘
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com