
题目列表(包括答案和解析)
7.有关二氧化硫的正确叙述是 ( )
A.二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 B.接触法制硫酸的沸腾炉排出的炉气中含
C.实验室可用启普发生器制取二氧化硫 D.用石灰水很容易区分二氧化碳和二氧化硫
答案: 7.B A项,SO2有还原性,能使溴水、高锰酸钾溶液褪色,B项沸腾炉反应为: (正确),C项Na2SO4 为粉末状,不可用启普发生器,D项
(正确),C项Na2SO4 为粉末状,不可用启普发生器,D项 都可使石灰水变浑浊
都可使石灰水变浑浊
6.为了方便某些化学计算,有人将98%的浓硫酸表示成下列形式,其中合理的是 ( )

答案: 6.A、D H2SO4:H2O的物质的量
5.飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是 ( )
①氧化剂;②还原剂;③催化剂;④吸附剂
A.①② B.① C.①③ D.③④
答案: 5.D
4.接触法制硫酸时接触室里有一个热交换器,关于它的作用比较确切的说法是 ( )
A.给催化剂加热
B.把反应生成的热传递给需要预热的反应混合物
C.为了提高反应温度,让水蒸气通过热交换器
D.为了充分利用余热,让冷水通过热交换器
答案: 4.B
3.FeS2在空气中充分燃烧的化学方程式为 ,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(N2)可表示为 ( )
,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(N2)可表示为 ( )
A.120N/a B.120a/llN C.1la/120N D.120N/lla
答案: 3.D
2.接触法制硫酸中没有涉及的设备是 ( )
A.沸腾炉 B.合成塔 C.吸收塔 D.接触室
答案: 2.B
1.接触法制硫酸的沸腾炉出来的炉气必须经过净化处理,其正确过程是 ( )
A.洗涤、干燥、除尘 B.干燥、除尘、洗涤
C.除尘、洗涤、干燥 D.除去硒和砷的化合物
答案:1.C 从沸腾炉出来的炉气中含有SO2、O2、N2水蒸气以及一些杂质,如砷、硒等的化合物和矿尘等。杂质和矿尘都会使催化剂中毒,水蒸气对设备和生产也有不利影响,因此对炉气必须进行除尘、洗涤、干燥。
25.(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体结构与NaCl相同,Na+ 与最邻近的O2-的核间距离为 cm,计算NiO晶体的密度。(已知NiO的摩尔质量为74.7g/mol)
cm,计算NiO晶体的密度。(已知NiO的摩尔质量为74.7g/mol)
(2)天然的和大部分人工晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个 所代替,其结果晶体仍呈电中性。但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中 Ni3+与Ni2+的离子数之比。
答案:25.


24.(8分)已知有关物质的熔、沸点数据如下表:
|
物质 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
熔点/ |
2852 |
2072 |
714 |
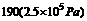 |
沸点 |
3600 |
2980 |
1420 |
182.7 |
请参考上述数据,填空和回答下列问题。
(1)22业上用电解熔融MgCl2的方法生产金属镁,电解A1203与冰晶石熔融混合物的方法生产铝。
为什么不用电解MgO的方法生产镁,也不用电解A1C13的方法生产铝?
 (2)设计可靠的实验,证明MgCl2、AlCl3所属的晶体类型,其实验方法是
.
(2)设计可靠的实验,证明MgCl2、AlCl3所属的晶体类型,其实验方法是
.
答案:24.(1)MgO的熔点很高,熔化需消耗大量能量,故不用电解MgO的方法制Mg.AlCl3属于共价化合物,形成分子晶体,在熔化状态下不导电
(2)先使MgCl2、AlCl3熔化成熔融状态,然后再根据其导电性,能够导电的为MgCl2,属离子晶体,不能导电的为AlCl3,为分子晶体
潜能测试
23.(12分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1:1或2:1形成化合物;C、B可与EA2反应生成C2 A 和气态物质EB4 ;E的M层电子数是K层电子数的2倍。
(1)写出这五种元素的名称:A ,B ,C ,D ,E 。
(2)画出E的原子结构示意图 。写出电子式 。
(3)比较EA2 与EB4 的熔点高低(填化学式) > 。(2分)
(4)写出D单质与Cu804溶液反应的离子方程式 。(2分)
答案:23.(1)A氧 B氟 C氢 D钠 E硅

(3)
本题突破点为E,M层电子数是K层电子数2倍,故E应为Si,且可知EA2为SiO2,气态EB2为SiF4,则有 ,则C为H,A为O,C、D分别与A形成原子个数比1:1或2:1化合物,可判为H2O2、Na2O
,则C为H,A为O,C、D分别与A形成原子个数比1:1或2:1化合物,可判为H2O2、Na2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com