
题目列表(包括答案和解析)
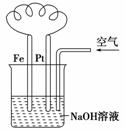
10.有关右图装置中的叙述正确的是 ( )
A.这是电解NaOH溶液的装置
 B.溶液中发生了变化:4Fe(OH)2+O2+2H2O 4Fe(OH)3
B.溶液中发生了变化:4Fe(OH)2+O2+2H2O 4Fe(OH)3
 C.Fe为正极,电极反应为:Fe-2e-+2OH-
Fe(OH)2
C.Fe为正极,电极反应为:Fe-2e-+2OH-
Fe(OH)2
D.NaOH溶液的碱性逐渐减弱
解析:这是一个原电池装置,也是一个吸氧腐蚀装置。电
极反应的书写应与电解质溶液的性质相联系。电解质pH的
变化应与电极反应相联系。
答案:B
9.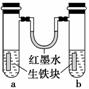 右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐
右图装置中,U形管内为红墨水,a、b试管内分别盛有食盐
水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关
描述错误的是 ( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-―→Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
解析:a中发生吸氧腐蚀,气体压强减小,b中发生析氢腐蚀,气体压强增大,
所以红墨水柱两边的液面变为左高右低,故B项错。
 答案:B
答案:B
8.有关X、Y、Z、W四种金属进行如下实验:
|
① |
将X和Y用导线连接,浸入电解质溶液中, Y不易腐蚀 |
|
② |
将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
|
③ |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以上事实,下列判断或推测错误的是 ( )
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,且X做负极
解析:由①得X>Y,②得W>X,③得Y>Z,则活泼性顺序为W>X>Y>Z。
答案:C
7.(2008·北京理综,5)据报道,我国拥有完全自主产权的氢氧燃料电池车将在北
京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下
列有关该电池的叙述不正确的是 ( )
 A.正极反应式为:O2+2H2O+4e-
4OH-
A.正极反应式为:O2+2H2O+4e-
4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
 C.该燃料电池的总反应方程式为:2H2+O2
2H2O
C.该燃料电池的总反应方程式为:2H2+O2
2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
解析:碱性氢氧燃料电池总反应式是2H2+O2===2H2O,不消耗和生成KOH,O2为正
极反应物,故A、B、C都正确;由Cl-生成0.1 mol Cl2转移0.2 mol电子,D错
误。
答案:D
6.关于铅蓄电池的说法正确的是 ( )
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)===PbSO4(s)+2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO42-(aq)
解析:A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO42-+
2e-===PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电
时阳极应发生氧化反应。
答案:B
5.(2009·江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如下图所示。关于该电池
的叙述正确的是 ( )

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体 L
解析:高温条件下,微生物失去生理活性,A不正确;B正确;放电过程中,
H+向正极移动,C不正确;结合B中负极反应和电子守恒可得电池总反应为:
C6H12O6+6O2―→6CO2+6H2O,消耗1 mol氧气,理论上生成CO2 1 mol,在标准状
况下的体积应为22.4 L,D不正确。
答案:B
4.(2010·东城期末)摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的
 新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。
新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。
其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法不正
确的是 ( )
A.充电时,电能转化为化学能
B.充电时,电解质溶液的pH逐渐增大
C.放电时,CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O
解析:分析充放电反应原理,可知,充电时,生成强碱,故pH逐渐增大;放电时,
CH3OH被氧化,故参与负极反应,发生氧化反应,电极反应式见D选项。
答案:C
3.(2009·广东)下列有关电池的说法不正确的是 ( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
解析:本题考查实用电池的有关知识。手机用电池是可充电电池,A对;铜锌原电
池,Cu为正极,Zn为负极,外电路中电子由负极流向正极,B错;燃料电池将化学
能转化为电能,C对;锌锰干电池,Zn为负极,D对。
答案:B
2.(2008·重庆理综,12)如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再
加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移
动),下列叙述正确的是 ( )

A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
解析:依据原电池原理分析可知:a中铁钉作负极,发生氧化反应,铜丝作正极发
生O2+2H2O+4e-===4OH-的还原反应,可知A、C错误;b中铁钉作正极,发生O2+
2H2O+4e-===4OH-的还原反应,而铝条发生氧化反应不会冒气泡,D错误。
答案:B
1.在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是
( )
A.电子从原电池的负极通过导线移动向正极
B.电子从原电池的正极通过导线移动向负极
C.阴离子在电解质溶液中向正极移动
D.阳离子在电解质溶液中向正极移动
解析:根据同一闭合回路中,同性电荷运动方向一致,异性电荷运动方向相反的
规律,在电解质溶液中阴离子向负极移动,阳离子向正极移动。
答案:AD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com