
题目列表(包括答案和解析)
1.Fe(OH)3胶体和MgCl2溶液共同具备的性质是 ( )
A.都比较稳定,密闭放置不产生沉淀 B.光线通过两者时,都有光亮的通路
C.加入盐酸先产生沉淀,后溶解 D.分散质粒子可透过滤纸
答案:1.AD本题考查胶体和溶液性质,胶体和溶液都比较稳定,胶体可产生丁达尔现象,加入电解质能聚沉,两者都能透过滤纸
3.胶体的净化方法
(1)混有溶液时--渗析。
(2)混有浊液时--过滤。
潜能开发
[例1]下列关于胶体的说法中正确的是 ( )
A胶体外观不均匀
B.胶体不能透过滤纸
C.胶粒直径在1 nm-100nm之间
D.胶体不稳定,静置后容易产生沉淀
思路分析
这是-个胶体概念的考查题,对胶体的外观、粒子的大小、布朗运动。及其胶体的稳定性均做了考查,从各个所给答案分析后直接可得出答案C。
[答案]C
[例2]下列物质不属于胶体的是 ( )
A.有色玻璃 B.澄清石灰水
C.淀粉溶液 D.FeCl3水
思路分析
A项中有色玻璃为固溶胶;B项中澄清石灰水为溶液;C项中淀粉溶液为高分子溶液,属于分子胶体;D项中FeCl3溶液中滴人沸水,会生成Fe(OH)3胶体,为液溶胶。
[答案]B [例3]下列变化属于物理变化的是 ( )
A.氧气在放电条件下变成臭氧( )
B.加热胆矾生成无水硫酸铜
C.漂白的草帽久置于空气中变黄
D.氢氧化铁胶体加入硫酸镁产生沉淀思路分析
判断是否是物理变化关键是看有无新物质生成,A中O2变为O3, B中 漂白草帽生成物不稳定,时间一长会分解,又变为黄色,因此都是化学变化,而D中Fe(OH)3胶体中加入电解质MgSO4,使胶体聚沉而产生Fe(OH)3沉淀,没有新物质生成,只有物理变化。
漂白草帽生成物不稳定,时间一长会分解,又变为黄色,因此都是化学变化,而D中Fe(OH)3胶体中加入电解质MgSO4,使胶体聚沉而产生Fe(OH)3沉淀,没有新物质生成,只有物理变化。
[答案]D
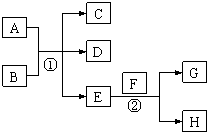
[例4]如下图已知:
(1)单质E可作半导体材料;(2)化合物F是不能生成盐的氧化物;(3)化合物I能溶于水呈酸性,可与A反应;A的水化物可形成胶体。
据此填空:
(1)化合物F是 ;(2)化合物I是 ;(3)反应③的化学方程式 ;(4)反应④的化学方程式 。
 思路分析
思路分析
由题中所叙述的条件与事实,单质E为半导体材料,化合物F为不成盐氧化物,A可形成胶体,结合框图中反应①可推知E、F分别为 Si和CO,反应①为 ,氧化物A是SiO2,它除了跟氢氟酸反应外不与任何酸反应,可知I为HF,由反应④可得HF和单质可知该反应为
,氧化物A是SiO2,它除了跟氢氟酸反应外不与任何酸反应,可知I为HF,由反应④可得HF和单质可知该反应为 。
。
[答案](1)CO(2)HF(3)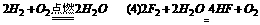
思维诊断
解这类题时,我们就按照A、B、C、D顺序逐个进行分析,按照所学胶体有关知.识即可找到答案,故解答正误判断题时一定要细心、全面。
思维诊断
解答本题要从所学胶体本质特征、组成、制备等多角度去思考。
思维诊断
解该题时,必须认清物理变化和化学变化的实质--即有无新物质生成,不能光看表面现象--发光、发热、有气体或沉淀产生,如D答案虽然产生了沉淀,但属于物理变化。
思维诊断
本题主要考查元素化合物的性质,是一道框图推断题,要求学生能在全面、系统地掌握元素及其化合物性质.的基础上,善于抓住某些元素的特殊性质,作为解题的突破口和切人点,如本题应抓住E为半导体材料,A的水化物可形成胶体,即可顺利推出答案。
知能达标训练
2.学习胶体时,要与溶液、悬浊液、乳浊液等概念从分散质粒子的直径、外观、稳定性、分散质的粒子能否透过滤纸、能否透过半透膜等方面进行比较。
学法建议
1.学习本节知识时一定要抓住胶体区别于其他分散系的本质特征,即分散质粒子的大小在 l nm-100nm之间。了解胶体的分类。这部分内容在高考中出现较少,一般渗透到一些综合题目中,有时也出现在一些容易或较容易的题中。
|
分 散 系 |
溶 液 |
胶 体 |
浊 液 |
|
分散质粒子大小 |
<1 nm |
1 nm-100 nm |
>100 nm |
|
外 观 |
均一透明 |
多数均一透明 |
不均一、不透明 |
|
分散质粒子 |
单个分子或离子 |
分子集合体或大分子 |
许多分子集合体 |
|
能否透过滤纸 |
能 |
能 |
不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
稳定性 |
稳定 |
较稳定 |
不稳定 |
|
实 例 |
盐酸、食盐水 |
鸡蛋的溶液等 |
泥水、牛奶 |
3.美国科学家鲍林在研究含氧酸的强弱时,提出了一个定性判断的经验规律,即含氧酸分子中的非羟基氧原子数与酸的强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸越强。
|
m-n |
0 |
1 |
2 |
3 |
|
含氧酸强度 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
|
实例 |
HClO |
H3PO3 |
HNO3 |
HClO4 |
已知亚磷酸(H3PO3)是中强酸,H3AsO3(亚砷酸)既有弱酸性又有弱碱性。
(1)写出在亚磷酸溶液中加入过量氢氧化溶液反应的离子方程式: ;
(2)写出在H3PO3和H3AsO3中分别加入盐酸,能反应的写出化学程式: ;
(3)在亚磷酸溶液中滴加硝酸银溶液,有黑色沉淀银生成及无色气体放出,写出此反应的化学方程式: ;
(4)该鲍林规则只是经验性的,有些例外,举一例: 。
[答案](1)H3PO3+2OH-=HPO32-+2H2O;
(2)H3AsO3+3HCl=AsCl3+3H2O
(3)2H3PO3+AgNO3=2H3PO4+Ag↓+NO↑
(4)H2CO3,m-n=1,但碳酸是弱酸,还有HCOOH、CH3COOH等。
2.酸碱中和滴定、一定物质的量浓度溶液的配制实验等是中学化学中重要的定量实验。
(1)配制一定物质的量浓度溶液时,容量瓶在使用前需检漏,应如何操作? ;
 (2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
;
(2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
;
(3)如图是三种定量仪器的一部分,在酸碱中和滴定
时应选用,在滴定接近终点时,应用蒸馏水圈
洗锥形瓶内壁,目的是 。
[答案](1)在容量瓶中加入一定量的水,倒转,看瓶塞周围有无水渗出;再将瓶塞旋转1800,再倒转,观察有无水渗出;(2)将两种溶液迅速混合可防止热量的散失,减小实验误差;(3)②圈洗可以使附着在锥形瓶壁的未反应的溶液回到溶液中,可避免滴定误差。
1.炼金废水中含有络离子[Au(CN)2]+,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.回答下列问题:
(1)HCN的电离方程式为 ,NaCN溶液pH 7(填大于,小于或等于) (2)与弱酸电离方式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为 ;
(3)处理这种废水时是在碱性条件下,NaClO将CN-氧化为CO32-和N2.其离子方程式为 ;
(4)在酸性条件下,NaClO也能氧化CN-,但实际处理废水时却不要酸性条件下进行的主要原因是 .
[答案](1)HCN H++CN-(2分);> (1分);
H++CN-(2分);> (1分);
(2)[Au(CN)2]+ [AuCN]2++CN-(2分)
[AuCN]2++CN-(2分)
(3)5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O(3分);
(4)在酸性条件下CN-与H+结合生成剧毒的HCN,对人体造成危害.(2分)
4.(16分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)

(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为____________________.(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为____________________.
(3)E与H反应的化学方程式是____________________;反应类型是__________.
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是__________.
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式.
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种.________________________________________
[答案](16分)(1)  (3分)
(3分)
(2)(酚)羟基、羧基(3分) (写对一个给1分,写错不得分)
(3)

(3分);酯化反应(或取代反应)(2分)
(4)聚苯乙烯(2分)
(5)  等(3分)
等(3分)
3.(16分)已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)
请回答下列问题:
(1)请写出反应②的化学方程式 ,当生成2.24L的G(标准状况)时,此时反应转移的电子数目为
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B为 。(写化学式)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂则反应①的方程式为
(5)A为红褐色难溶于水的固体,B为“84消毒液”的有效成分,两者在浓碱溶液中发生反应生成了高效环保的净水剂Na2FeO4,请写出此反应的离子方程式
(书写方程式请注意碱性介质的参与)
[答案](16分)
(1)2Na2O2+2H2O=4NaOH+O2↑ (3分) 0.2NA (2分)
(2)Cl2+2OH-= Cl- + ClO- +H2O (3分)
(3) C、浓H2SO4 (2分)
(4)2NH4Cl+Ca(OH)2 CaCl2 +2H2O+2NH3↑
(3分)
CaCl2 +2H2O+2NH3↑
(3分)
(5)2Fe(OH)3 + 3 ClO-+4OH-=2FeO42-+3 Cl-+5H2O (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com