
题目列表(包括答案和解析)
4.一定量的质量分数为14%的KOH溶液,若蒸发掉100 g水后,其质量分数变为28%,体积为125 mL,则浓缩后的KOH溶液的物质的量浓度为
( )
A.2.2 mol/L B.4 mol/L
C.5 mol/L D.6.25 mol/L
解析:设浓缩后溶液的质量为m,据蒸发前后溶质的质量不变列出方程:
(m+100 g)×14%=m×28% m=100 g,
故原溶液中溶质质量m′=200 g×14%=28 g,
n(KOH)==0.5 mol,
则c===4 mol/L,选B.
答案:B
3.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中正确的是
( )
A.称量时,将NaOH固体直接放在天平托盘上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
解析:A错误,称量NaOH时需放在玻璃器皿中称量,因NaOH有腐蚀性;B错误,应先将称好的NaOH放入烧杯中溶解,再转移至容量瓶;C错误,NaOH在烧杯中溶解待冷却至室温后方可转入容量瓶中;D正确,容量瓶未干燥对结果无影响.
答案:D
2.关于0.2 mol/L的NaOH溶液,下列说法不正确的是
( )
A.100 mL该溶液中含0.8 g NaOH
B.200 mL该溶液与100 mL 0.2 mol/L的硫酸溶液反应形成中性溶液
C.100 mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+
D.配制含1 L水的该溶液,需NaOH的质量为8 g
解析:A项中,m(NaOH)=0.2 mol/L×0.1 L×40 g/mol=0.8 g,正确;
B项,2NaOH+H2SO4===Na2SO4+2H2O,所以==2∶1,符合化学方程式的化学计量数之比,正确;C项,N(Na+)=0.2 mol/L×0.1 L×6.02×1023 mol-1=0.02×6.02×1023,正确;D项,含1 L水的这种溶液,溶液的体积肯定不是1 L,NaOH的质量就不能以1 L溶液来计算了,错误.
答案:D
1.下列有关物理量相应的单位表达错误的是
( )
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100 g D.密度g/cm3
解析:本题考查的是化学常用物理量的单位.溶解度的单位是g,故C错误.
答案:C
7.形成酸雨的原理之一可简示如下:含硫燃料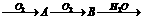 硫酸。回答下列问题:
硫酸。回答下列问题:
反应① 反应② 反应③
(1)A物质的化学式 ,B物质的化学式 。
(2)三个反应中不属于氧化还原反应的是 (填序号)。
(3) 中硫元素显+4价,它可能降低到。价,利用这一性质可在工厂的烟道气中通人合适的 (填“氧化剂”或“还原剂”)除去 ,达到减小污染的目的。
(4)从环境保护的角度认为:雨水的pH<5.6时,就判断为酸雨。已知pH=[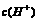 ],经测定某次雨水中只含硫酸,且浓度为
],经测定某次雨水中只含硫酸,且浓度为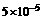 ,这次降雨 (填“是”或“不是”)酸雨。
,这次降雨 (填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有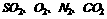 等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到?70年代的10年间,由发电厂排放的SQ增加了35%。但由于建造高烟囱的结果,地面浓度降低了30%之多。
等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到?70年代的10年间,由发电厂排放的SQ增加了35%。但由于建造高烟囱的结果,地面浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是 。
A.少用煤作燃料 B.把工厂屠囱造高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建造高烟囱的方法是否可取 ,理由是
6.汽车尾气(含有烃类、CO、SO2与NO等物质)治理方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式 。
(2)“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是: 。
(3)控制城市空气污染源的方法可以有 。(多选扣分)
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
答案: 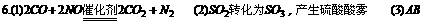
5.工厂的工业废水,不可直接往江河排放,否则会造成严重危害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有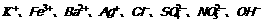 中的四种。又知甲厂污水pH>7。
中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是: 。
(2)乙厂污水中含有的四种离子可能是: 。
(3)乙厂进行废水处理,方法之一,可往废水中加入一定量的 (选填:“活性炭…‘硫酸亚铁” “铁粉”),可以回收其中的金属 (填元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水中的 (填离子符号)转化为沉淀再排放,则大大降低污染程度。过滤,所得废水主要含 ,可用于浇灌农田。
答案: 5.
4.大气污染是环境的一个重要方面,常见的大气污染物分一次污染物和二次污染物。二次污染物是排人环境中的一次污染物在物理化学因素或生物作下发生变化,或与环境中的其他物质发生反应,生成新的污染物。如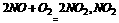 就是二次污染物,由 NO2导致的污染就是的二次污染。下列物质①SO2;②NO;③NO2;④CHl;⑤CO2不易导致二次污染的是 ( )
就是二次污染物,由 NO2导致的污染就是的二次污染。下列物质①SO2;②NO;③NO2;④CHl;⑤CO2不易导致二次污染的是 ( )
A.①②③④⑤ B.①③⑤ C.④⑤ D.只有④
答案: 4.C
3.治理“三废”,保护环境,最主要的方法是 ( )
A.减少污染严重的工厂 B.把“三废”深埋
C.提高认识 D.变废为宝,综合利用
答案: 3.D
2.下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
答案: 2.C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com