
题目列表(包括答案和解析)
19.(2010·运城月考)(9分)某化学小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁管感觉发热外,还设计了下列几个可行性方案.
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是__________________________,________,说明反应放热.(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①和②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①)________,(接②)________,说明反应放热.
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是________________ ,说明反应放热,其原因是________________________________________.
解析:实验从反应放热的“热”为出发点进行探究,通过放热使温度上升、使气体膨胀、水被蒸发等特征现象,合理地设计了实验探究方案.
答案:方案甲:小试管中固体变成乳状,同时有大量水蒸气产生 温度计温度上升
方案乙:①有气泡产生 ②左边水柱下降,右边水柱上升
方案丙:无水硫酸铜粉末变蓝色 水和生石灰反应放出热量,使水蒸发
18.(9分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和反应热.
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值________(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会________(填“偏大”、“偏小”或“无影响”,下同);用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和反应热的数值会________.
解析:(1)据图知,装置中缺少环形玻璃搅拌捧.
(2)若大烧杯上不盖硬纸板,则会导致热量损失使中和热的数值偏小.
(3)因氨水是弱碱,在发生中和反应时,逐步电离出OH-会吸收热量,故测得中和热的数值偏小;若用50 mol 0.50 mol/L的NaOH溶液来做实验难以保证50 mL 0.50 mol/L的盐酸完全反应,故测得中和热数值也会偏小.
答案:(1)环形玻璃搅拌棒
(2)偏小
(3)偏小 偏小
17.(5分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出 256.652 kJ的热量.
(1)反应的热化学方程式为____________________.
(2)又已知H2O(l)===H2O(g) ΔH=+44 kJ/mol,由16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________.
解析:(1)首先据得失电子守恒即可配平该氧化还原反应为N2H4+2H2O2===N2↑+4H2O,因此1 mol N2H4(l)完全反应放出热量是256.652 kJ×=641.63 kJ.因此热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.63 kJ/mol.
(2) 利用盖斯定律,(1)-(2)×4即得
N2H4(l)+2H2O2(l)===N2(g)+4H2O(l),因此反应热ΔH=-641.63 kJ/mol-(+44 kJ/mol)×4
=-817.63 kJ/mol.所以 16 g(即0.5 mol) N2H4(l)与液态H2O2反应生成液态H2O放出热量为817.63 kJ/mol×0.5 mol=408.815 kJ.
(3)因产物为N2和H2O,故不会造成环境污染.
答案:(1)N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)
ΔH=-641.63 kJ/mol
(2)408.815
 (3)产物不会造成环境污染
(3)产物不会造成环境污染
16.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
解析:A项,增大压强,平衡向逆反应方向移动,SiCl4的转化率减小;B项,由于此反应为可逆反应,开始时加入的1 mol SiCl4并不能全部转化为Si,所以吸收的热量小于Q kJ;C项,v(H2)=v(HCl)=×=0.015 mol/(L·min). D项,当反应吸收热量为0.025Q kJ时,产生n(HCl)=4 mol×=0.1 mol=n(NaOH),故恰好反应.
答案:D
第Ⅱ卷 (非选择题,共52分)
15.用NA代表阿伏加德罗常数的值,下列有关热化学方程式H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ/mol的说法中正确的是
( )
A.有4NA个电子转移时,放出 285.8 kJ的热量
B.有NA个水分子生成且为液体时,吸收285.8 kJ的能量
C.有2NA个氢氧共用电子对生成时,放出285.8 kJ的能量
D.有0.1NA个氢氧共用电子对生成时,放出285.8 kJ的能量
解析:据热化学方程式知,放出285.8 kJ的热量,则转移的电子为2NA,有NA个液态水分子生成,即2NA个氢氧共用电子对生成,故A、B、D错误,C正确.
答案:C
14.已知25℃、101 kPa条件下:
①4Al(s)+3O2(g)===2Al2O3(s)
ΔH=-2834.98 kJ/mol
②4Al(s)+2O3(g)===2Al2O3(s)
ΔH=-3119.18kJ/mol
由此得出的正确结论是
( )
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.反应①可确定铝的燃烧热是708.7 kJ
C.O3比O2稳定,由O2变O3为放热反应
D.根据②可确定铝的燃烧热是779.8 kJ/mol
解析:据两热化学方程式知2 mol O3(g)比3 mol O2(g)(等质量)的能量高,所以由O2变为O3为吸热反应,故A正确C错误;据燃烧热的概念可知铝的燃烧热应该由反应①确定,燃烧热为708.7 kJ/mol,故B、D均错误.
答案:A
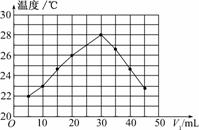
13.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).下列叙述正确的是
( )
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
解析:从图中曲线可以看出,温度为22℃时,V1为5 mL,则V2为45 mL,此时已经开始发生反应,所以22℃一定不是室温,A错.从曲线随V1的增多而升高,随反应的进行,溶液温度升高说明反应放热,化学能转化为热能,B正确.当V1=30 mL时温度最高,说明此时两者恰好完全反应,则c(NaOH)==1.5 mol/L,C错.该实验不能证明有水生成的其他反应也是放热的.
答案:B
12.下列变化中,一定不存在化学能与热能相互转化的是
( )
A.铝热反应 B.金属钝化
C.燃放爆竹 D.干冰气化
解析:D项中干冰的气化属于物质的三态变化,能量变化但物质没变,是物理变化,而A项、B项、C项均属于化学反应,存在化学能与热能的转化.
答案:D
11.下列说法不正确的是
( )
A.化学变化过程是原子的重新组合过程
B.化学反应可分为吸热反应和放热反应
C.化学反应中能量变化多少与其反应量无关
D.化学变化中的能量变化都是以热能形式表现出来的
解析:化学变化过程即原子的重新组合的过程,A正确;据化学反应的热效应可将化学反应分为吸热反应和放热反应,B正确;一个化学反应的能量变化与其反应量有关系,C错误;化学变化中能量变化主要以热能形式表现,还可有光能等,D错误.
答案:CD
10.灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)  Sn(s,白) ΔH3=+2.1 kJ/mol
Sn(s,白) ΔH3=+2.1 kJ/mol
下列说法正确的是
( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
解析:由③式可以看出,ΔH3>0,灰锡转化为白锡的反应是吸热反应,由此可以说明白锡具有的能量高于灰锡的能量,|ΔH1|>|ΔH2|.由于反应①②都是自发的氧化还原反应,ΔH1<0,ΔH2<0,所以ΔH1<ΔH2.常温下,灰锡将自发地转化为白锡,说明锡在常温下以白锡状态存在.锡制器皿(白锡)长期处于低于13.2℃的环境中,会发生白锡向灰锡转化的反应,由于灰锡以粉末状存在,所以锡制器皿会自行毁坏.由ΔH3=ΔH2-ΔH1>0,也可知A、C项错误.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com