
题目列表(包括答案和解析)
6.在密闭容器中进行如下反应:X2(g)+Y2(g)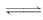
 2Z(g).已知X2、Y2、Z的起始浓度分别为0.1
mol/L 、0.2 mol/L和0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g).已知X2、Y2、Z的起始浓度分别为0.1
mol/L 、0.2 mol/L和0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
( )
A.Z为0.3 mol/L B.Y2为0.4 mol/L
C.X2为0.2 mol/L D.Z为0.4 mol/L
解析: A项,若Z为0.3 mol/L,则表明此时X2为0.05 mol/L,故可能;B项,Y2为0.4 mol/L,Z全部反应也不可能达到;C项,X2为0.2 mol/L,此时Z为0 mol,不可能;D项,Z为0.4 mol/L,则Y为0 mol,不可能.
答案:A
5.(2009·东北三校高三联合模拟)某温度下,在容积固定不变的密闭容器中进行如下可逆反应:
X(g)+Y(g)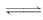
 Z(g)+W(s) ΔH>0
Z(g)+W(s) ΔH>0
一段时间后,达到化学平衡状态.下列叙述正确的是
( )
A.通入稀有气体,平衡向正反应方向移动
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
解析:A项,恒温恒容时充入稀有气体,原反应体系各物质中物质的量浓度不变,平衡不移动;B项,W是固体,再加入少量,反应速率不变;C项,升高温度,正、逆反应速率均增大;D项,该反应正反应方向是吸热反应,则降低温度平衡向逆反应方向移动.
答案:D
4.(2009·湖南省地质中学高考模拟)
一定温度下,在体积为V L的密闭容器中加入1 mol X和1
mol Y进行如下反应: X(g)+Y(g)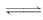
 2Z(g)+W(s) ΔH>0达到平衡,下列判断正确的是
2Z(g)+W(s) ΔH>0达到平衡,下列判断正确的是
( )
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入X,上述反应的ΔH增大
C.温度不变,将容器的体积变为2V L, Z的平衡浓度变为原来的1/2
D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
解析:该反应为气体体积不变的反应,无论反应是否达到平衡,压强都不变,故D错误;压强的改变对该平衡无影响,故将容器的体积变为2V L,相当于将压强减小为原来的二分之一,平衡不移动,Z的浓度变为原来的1/2,C正确;对于纯液体或固体来说,无所谓浓度,故增加纯液体或固体不影响反应速率和平衡,A错;该反应的焓变ΔH是指生成2 mol Z时放出的热量,与X的用量无关,B错.
答案:C
3.下列不能用勒夏特列原理解释的是
( )
A.在溶液中存在:I2+I-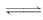 I,在配制碘水时,加入少量的KI,可以增大I2的溶解性
I,在配制碘水时,加入少量的KI,可以增大I2的溶解性
B.在配制FeCl2、FeCl3溶液时,一般是将 FeCl2、FeCl3固体溶解在HCl中,从而可得澄清的溶液
C.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体
D.在一容器中有一定量的N2和H2,加入催化剂会使合成氨的速率加快
解析:A选项中向存在I2+I-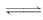 I的平衡中加入KI,会使平衡正向移动,从而可以使I2溶解得更多;B选项中配制FeCl2、FeCl3溶液时,会因Fe2+、Fe3+水解而出现浑浊,当加入HCl时可以抑制它们的水解,即使水解平衡向逆反应方向移动;C选项中Fe3+在溶液中存在平衡;Fe3++3H2O
I的平衡中加入KI,会使平衡正向移动,从而可以使I2溶解得更多;B选项中配制FeCl2、FeCl3溶液时,会因Fe2+、Fe3+水解而出现浑浊,当加入HCl时可以抑制它们的水解,即使水解平衡向逆反应方向移动;C选项中Fe3+在溶液中存在平衡;Fe3++3H2O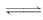
 Fe(OH)3+3H+,加入的CuO、Cu(OH)2会中和产生的H+,促使Fe3+进一步水解而形成沉淀除去.勒夏特列原理是外界条件改变时,判断平衡移动方向的原理,而不能解释反应速率的变化.
Fe(OH)3+3H+,加入的CuO、Cu(OH)2会中和产生的H+,促使Fe3+进一步水解而形成沉淀除去.勒夏特列原理是外界条件改变时,判断平衡移动方向的原理,而不能解释反应速率的变化.
答案:D
2.对可逆反应4NH3(g)+5O2(g)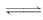 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小 ,逆反应速率增大
D.化学反应速率的关系是:2v正(NH3)=3v正(H2O)
解析:化学平衡的实质是可逆反应的正反应速率与逆反应速率相等,选项A正确;选项B表示的都是正反应速率,没有逆反应速率,不正确;增大容积,反应物、生成物的浓度均减小,所以正、逆反应速率均减小,C不正确;在同一反应中,用不同物质所表示的同一化学反应的速率之比等于其化学方程式中的计量数之比,选项D错误.
答案:A
1.(2009·山东济南月考)下列关于化学反应限度的说法中正确的是
( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了 化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
解析:A项,外界条件改变时,可能会改变反应的限度.C项,如反应H2(g)+I2(g)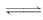 2HI(g),在恒容条件下,压强一直不变,因此压强不变不能作为反应达到反应限度的标志.D项,反应达到限度时,反应物和生成物的浓度不再变化,并不一定相等.
2HI(g),在恒容条件下,压强一直不变,因此压强不变不能作为反应达到反应限度的标志.D项,反应达到限度时,反应物和生成物的浓度不再变化,并不一定相等.
答案:B
13.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)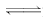
 CH3OH(g).
CH3OH(g).
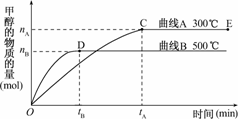
根据题意和所给图象完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=________,升高温度,K值________(填“增大”“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________.
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
( )
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是____________________(用化学方程式表示).
解析:(1)化学平衡常数为在一定温度下,某个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数.由图象可以看出,升高温度,平衡向左移动,K值减小.
(2)v(CH3OH)=mol/(L·min),
v(H2)=2v(CH3OH)=mol/(L·min).
(3)a项缩小体积,无论平衡如何移动,H2的浓度应增大;缩小体积,压强增大,速率加快,平衡正向移动,n(H2)/n(CH3OH)减小.
(4)加热时,CO和H2能够还原Cu2O,根据题给信息,CO2能够抑制反应的条件,自然得出答案.
答案:(1) 减小
(2)mol/(L·min) (3)bc
(4)Cu2O+CO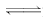
 2Cu+CO2
2Cu+CO2
12.(2009·广东汕头模拟)在密闭容器中进行如下反应:mA(g)+nB(g)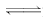
 pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了a mol/L,又知平均反应速率:v(C)=2v(B).
pC(g),反应经5 min达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了a mol/L,又知平均反应速率:v(C)=2v(B).
 (1)写出上述化学方程式中各物质的计量数:m=________, n=________, p=________.
(1)写出上述化学方程式中各物质的计量数:m=________, n=________, p=________.
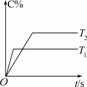
(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如右图所示.
由此可知,该反应为________(填“吸热”或“放热”)反应.
(3)该反应的平衡常数表示式为________;升高温度,K值将________(填“增大”“减小”或“不变”).
解析:(1)根据速率之比等于计量数之比,即m∶n∶p=3∶1∶2,故m=3, n=1, p=2.
(2)由图象可知T1>T2,升温C%减小,平衡逆向移动,说明正反应为放热反应.
(3)K=,升温K减小.
答案:(1)3 1 2 (2)放热
(3)K= 减小
11.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得:
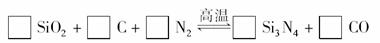
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是________,其还原产物是________;
(3)该反应的平衡常数表达式为K=________;
(4)若知上述反应为放热反应,则其反应热ΔH________零(填“大于”“小于”或“等于”);升高温度,其平衡常数值________(填“增大”“减小”或“不变”);
(5)若使压强增大,则上述平衡向________反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18 mol/(L·min),则N2消耗速率为v(N2)=________mol/(L·min).
解析:(1)利用氧化还原反应配平方法不难得出化学计量数分别为3、6、2、1、6.
(2)根据化合价变化可判断出N2为氧化剂,Si3N4为还原产物.
(3)根据平衡常数的定义得出该反应的平衡常数表达式为K=.
(4)放热反应,ΔH<0.升高温度平衡逆向移动,平衡常数减小.
(5)从配平后的化学方程式的化学计量数可以看出气态物质的计量数之和是生成物的大于反应物的,故增大压强可使平衡逆向移动.
(6)同样从上述化学方程式中的计量数关系中可以得出v(N2)=×18 mol/(L·min)=6 mol/(L·min)
答案:(1)3 6 2 1 6
(2)N2 Si3N4
(3) (4)小于 减小 (5)逆 (6)6
10.可用下图所示的图象表示的反应是
( )
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
SO2与O2在同温、同体积容器中反应 |
SO2的 转化率 |
2
mol SO2 和1 mol O2 |
2
mol SO2 和2 mol O2 |
|
B |
2
mol SO2与1 mol O2在同温、体积可变的恒压容器中反应 |
SO2的 转化率 |
1×106Pa |
1×105Pa |
|
C |
相同质量的氨在同一固定容积容器中反应 |
氨气的 浓度 |
400℃ |
500℃ |
|
D |
体积比为1∶3的N2、H2在同温、体积可变的恒压容器中反应 |
氨气的 浓度 |
活性高的 催化剂 |
活性一般 的催化剂 |
解析:A项中由于乙中氧气比甲中多,故乙中SO2的转化率比甲大,不符合图象;B项中由于乙的压强比甲小,故乙的化学反应速率小,到达平衡时间比甲长,不符合图象;D项中平衡时氨气的浓度应相同,不符合图象.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com