
题目列表(包括答案和解析)
3.(2010·日照调研)某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为c(X2)=0.4 mol/L,c(Y2)=0.8 mol/L,c(Z)=0.4 mol/L,则该反应的反应式可以表示为
( )
A.X2+2Y2===2XY2 B.2X2+Y2===2X2Y
C.3X2+Y2===2X3Y D.X2+3Y2===2XY3
解析:Δc(X2)=1 mol/L-0.4 mol/L=0.6 mol/L,Δc(Y2)=1 mol/L-0.8 mol/L-1=0.2 mol/L,Δc(Z)=0.4 mol/L,则Δc(X2)∶Δc(Y2)∶Δc(Z)=3∶1∶2,化学方程式为3X2+Y2===2Z.
再由质量守恒(分子个数守恒)推知Z化学式为X3Y.
答案:C
2.已知4NH3+5O24NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(H2O)、v(NO)(mol/(L·min))来表示,则正确的关系是
( )
A.v(NH3)=v(O2)
B.v(O2)=v(H2O)
C.v(NH3)=v(H2O)
D.v(O2)=v(NO)
解析:同一反应用不同物质来表示反应速率时,速率之比等于方程式的化学计量数之比,A中v(NH3)=v(O2),系数关系不对,因此不正确;同理B、C均不正确.
答案:D
1.一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤
C.③④⑤ D.①③④
解析:①③中所加物质与锌粉在盐酸中形成许多微小原电池,使反应速率加快;②中CuO溶于盐酸后会消耗锌,使H2总量变小;④中铁粉会与过量的盐酸反应,使H2总量增加.
答案:B
13.(2009·黄岗中学高三质检)X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1)Y的元素符号是________.
(2)XW的电子式是________.
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)______________________________.
(4)Z元素氢化物的沸点比H2O________(填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式____________________.
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是________.
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
解析:X元素的原子核外电子数等于其电子层数,则X是H,H与Y形成极易溶于水的YH3,则可推Y是N元素,由XW是共价化合物,可知W是Cl,XW是HCl,Z原子序数介于N和Cl之间,且Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,则可知Z是S元素,反应方程式为2H2S+SO2===3S↓+2H2O.HCl与NH3反应生成NH4Cl,该盐水溶液的pH小于7,原因是NH的水解.
H2S的沸点比H2O低,原因是水分子间存在氢键.
v正=v逆是反应达到平衡的标志,故a对.
N2 + 3H2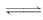
 2NH3
2NH3
1 1 0
x x
1- 1-x x
恒温恒压条件下,体积之比等于物质的量之比,由V(N2)%==,和x无关,b正确;c显然错误;总物质的量在减小,总质量不变,所以气体平均相对分子质量增大,d错误;正反应是放热反应,所以升高温度,平衡逆向移动,YX3的体积分数减小,e错误.
答案:(1)N (2)H····
(3)小于 NH+H2O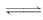
 NH3·H2O+H+
NH3·H2O+H+
(4)低 Cu2++H2S===CuS↓+2H+
(5)ab
12.(2009·山东实验中学诊断)将2 mol I2(g)和1 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)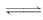
 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.
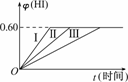
(1)达平衡时,I2(g)的物质的量浓度为________.
(2)若保持温度不变,在另一相同的2 L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________.
解析:(1)设平衡时I2(g)的物质的量浓度为c,则平衡时H2(g)的物质的量浓度为0.5-(1-c)=c-0.5,平衡时HI(g)的物质的量浓度为2(1-c),故=0.6,解得c=0.55 mol/L.
(2)恒温恒容条件下,对于反应前后气体的分子数相等的可逆反应,只要通过化学计量数换算成相成同物质时浓度之比与原来相同,就可以建立等效平衡.即(a+0.5c)∶(b+0.5c)=2∶1,解得4b+c=2a.
答案:(1)0.55 mol/L (2)4b+c=2a
11.已知NO2和N2O4可以相互转化:2NO2(g)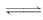
 N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
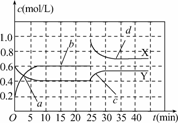
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________.
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是______________________________.
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________.
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
解析:(1)曲线X在0-10 min达平衡时变化了0.4 mol/L,而曲线Y在1-10 min达平衡时变化了0.2 mol/L,所以可得X曲线为NO2的浓度变化曲线;达到平衡时浓度不再随时间而发生变化,所以b、d表示反应已达平衡状态;
(2)NO2在0-10 min达平衡时变化了0.4 mol/L,所以用NO2表示的反应速率为0.04 mol/(L·min);而在25 min时,NO2的浓度由0.6 mol/L变为1.0 mol/L,而N2O4的浓度在25 min时没有发生改变,所以可得此时改变的条件是向容器中加入了0.4 mol NO2气体.
(3)在加入NO2后平衡正向移动,所以若要达到与最后相同的化学平衡状态,还可通过增大压强,使平衡也同样正向移动;或者采用降低温度的方法,使平衡正向移动,也可以向容器中充入一定量N2O4气体,因为这样相当于增大容器中气体的压强,使得NO2的转化百分率提高,即达到与最后的平衡相同的平衡状态.
答案:(1)X b和d (2)0.04 加入了0.4 mol NO2 (3)BD
10.下列叙述能肯定某化学平衡发生移动的是
( )
A.反应混合物浓度的改变
B.正逆反应速率的改变
C.反应混合物百分含量的改变
D.反应体系中气体总压强改变
解析:A项,若是反应前后气体体积守恒的反应,通过加压,反应混合物的浓度均增大,平衡并不移动;B项,正逆反应速率如果是同等程度改变,则平衡并不移动(如使用催化剂);C项,反应混合物百分含量改变,平衡肯定移动;若是恒容容器,达平衡时,再充入不反应的稀有气体,虽气体总压强增大,但各成分的浓度不变,平衡不发生移动.
答案:C
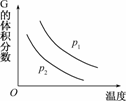
9.(2009·北京朝阳高三统考)在一密闭容器中有如下反应:
L(s)+aG(g)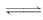
 bR(g)
bR(g)
温度和压强对该反应的影响如右图所示,其中压强p1<p2,由此可判断
( )
A.正反应为放热反应
B.化学方程式中的计量数a>b
C.G的转化率随温度升高而减小
D.增大压强,容器内气体质量不变
解析:由图可知,p1→p2,增大压强,G体积分数减小,即平衡向正反应方向移动 ,则a>b,容器内气体质量增大,故B对、D错.T升高,G的体积分数减小,即平衡向正反应方向移动,则该反应的正反应为吸热反应,G的转化率增大,故A、C均错.
答案:B
8.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g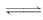
 CH3OH(g) ΔH<0.第2 min时只改变一个条件,反应情况如下表:
CH3OH(g) ΔH<0.第2 min时只改变一个条件,反应情况如下表:
|
时间 |
c(CO)/ mol/L |
c(H2)/ mol/L |
c(CH3OH)/ mol/L |
|
起始 |
1 |
3 |
0 |
|
第2 min |
0.8 |
2.6 |
0.2 |
|
第4 min |
0.4 |
1.8 |
0.6 |
|
第6 min |
0.4 |
1.8 |
0.6 |
下列说法不正确的是
( )
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
解析:第4 min-6 min,各组分的浓度不再改变,所以化学反应处于平衡状态,A正确;第2 min到第4 min反应速率比起始到第2 min的快,所以不可能是降低温度,可能是加入催化剂,故B错误,C正确;升高温度,不论吸热反应还是放热反应,其反应速率均增大,D正确.
 答案:B
答案:B
7.已建立化学平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述中正确的是
( )
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤
C.③⑤ D.④⑥
解析:若通过增大某一反应物的用量引起平衡正移,可能会使生成物的含量降低,①错误;只要平衡正向移动,则生成物的产量一定增加,②正确;若通过增大一种反应物的浓度使平衡正移,这种反应物自身的转化率一般会降低,而另一反应物的转化率升高,所以③④均错误;平衡正移,则v正>v逆,⑤正确;加入催化剂,只会加快反应速率,而不会引起平衡移动,故选B.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com