
题目列表(包括答案和解析)
1. 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.25°C时,pH=13的Ca(OH)2溶液中含有的OH-数目为0.2NA
B.0.1molPCl3中形成共价键的电子数是0.3NA
C.3.0 g淀粉和葡萄糖混合物中共含碳原子数0.1NA
D.标准状况下,1mol SO3含有的分子数为NA
6. 下表中的因果关系完全正确的是
|
选项 |
结 论 |
原 因 |
|
A |
向酸性高锰酸钾溶液中通入SO2,紫色褪去 |
SO2具有漂白性 |
|
B |
ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 |
CuS的Ksp比ZnS的Ksp小 |
|
C |
在氨性BaCl2溶液中通入CO2,有白色沉淀生成 |
NH3在反应中作催化剂 |
|
D |
单质硅不溶于浓硫酸和浓硝酸 |
硅被强氧化性酸钝化 |
第二组
5. TBC是优良的增塑剂,具有很好的相容性,且挥发性小、耐寒、耐光及耐水等,广泛用于医学卫生用品,它的结构式如下图一所示。下列说法中正确的是
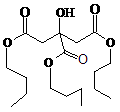
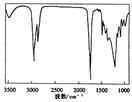
图一 图二
A.TBC分子中不存在手性碳原子
B.TBC分子既能发生催化氧化反应又能发生消去反应
C.TBC分子在碱性条件发生水解只得到2种有机产物
D.上图二表示的是TBC分子的1H-NMR图谱
4. 下列说法正确的是
A.硝酸铵在一定条件下受热分解的产物可能是NH3、NO、H2
B.常温下,pH之和为14的醋酸和苛性钠溶液混合后溶液显碱性
C.用甲基橙作指示剂,用已知浓度的NaOH溶液滴定未知浓度的醋酸,导致测定结构偏低(其余操作均正确)
D.根据AgCl的溶度积可知当AgNO3溶液和NaCl溶液等体积混合后,一定有c(Ag+)=c(Cl-)
3. 下列离子方程式书写正确的是
A.向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化:2Fe2++Cl2==2Fe3++2Cl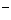
B.NaOH溶液与足量的Ca(HCO3)2反应:HCO3- +OH-+Ca2+ = CaCO3↓+H2O
C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:
Ba2+ + OH- + H+ + SO42-=BaSO4↓ + H2O
D.Na2CO3溶液吸收Br2蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
2. 氧可与许多元素形成化合物,下列有关叙述错误的是
A.H3O+的结构式为 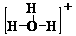
B.氧与氟形成的化合物OF2中,氧元素的化合价为-2价
C.Na2O2的电子式为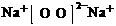
D.在Mg18O晶体中,阴离子结构示意图可表示为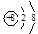
1.化学与科学、技术、环境密切相关。下列有关说法中正确的是
A.由石墨剥离而成的石墨烯属于烯烃
B.使用正己烷代替酒精擦试手机屏幕
C.“赤潮”和“水华”均是水体富营养化引起的
D.大力开发丰富的煤炭资源,减少对石油的依赖
13.(1)安全教育是化学教育的重要内容.根据你掌握的知识判断,下列各项中符合安全操作要求的是________(填写序号).
①在加油站内拨打手机
②在煤矿巷道内用明火照明
③闻氯气的气味时,用手轻轻在瓶口扇动,仅使极少量的氯气飘进鼻孔
④为了节约药品,锌与稀硫酸一开始反应,就做氢气点燃实验
⑤稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌
(2)下图为常见仪器的部分结构(有的仪器被放大):
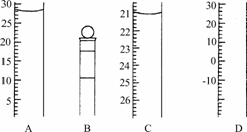
A图中液面所示溶液的体积为________mL,C图中液面所示溶液的体积为________mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是________(填仪器序号字母).
(3)粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐.
①蒸发操作中使用到的瓷质仪器的名称为________.
②该同学将所得精盐配成溶液,用于另一实验.实验中需要用100 mL 1 mol/L的NaCl溶液,配制过程中需用托盘天平称取的精盐质量为________g,用于定容的玻璃仪器的规格和名称是________.
解析:(1)①②均易发生爆炸,错误;③利用扇动法闻气体的气味,正确;④开始是H2和空气的混合气体,易发生爆炸,错误;⑤中稀释浓H2SO4就应把浓H2SO4注入水中并不断搅拌,正确.
(2)根据仪器特点分析:A为量筒,读数时应平视,读数为28.0 mL,B为容量瓶,C为滴定管,小刻度在上,大刻度在下,故仰视读数偏大,D为温度计.
(3)①蒸发时用到的瓷质仪器为蒸发皿;②m(NaCl)=0.1 L×1 mol/L×58.5 g/mol=5.85 g,但称量时应称5.9 g,配制时需要100 mL容量瓶.
答案:(1)③⑤ (2)28.0 21.10 C
12.铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
 (1)药片上的糖衣可以起________作用,鉴定时溶解加盐酸的目的是________.
(1)药片上的糖衣可以起________作用,鉴定时溶解加盐酸的目的是________.
(2)某研究小组甲欲用KMnO4测定FeSO4的含量.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液200毫升,配制时需要的仪器除天平外,还需要的仪器有________、________、________、________、________.
②滴定时含硫酸亚铁的滤液放在________(填仪器)中,高锰酸钾溶液放在________(填仪器)中,滴定终点时溶液的颜色为________色.
(3)另一研究小组乙设计了如下测量方案:
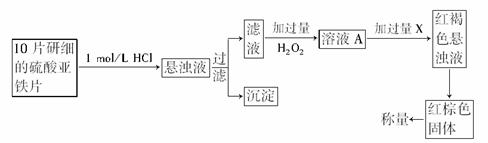
①过滤时用到的玻璃仪器有________.
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有________(按操作的顺序填写).
A.过滤 B.洗涤 C.萃取 D.分液
E.冷却 F.灼烧
解析:(1)Fe2+具有强还原性,能发生水解,因此药片上的糖衣的作用是隔绝空气,防止FeSO4被氧化;溶解时加盐酸的目的是为了防止Fe2+水解.
(2)配制一定物质的量浓度的KMnO4溶液需要的仪器有托盘天平(药匙,砝码)、量筒、200 mL容量瓶、烧杯、玻璃棒、胶头滴管.滴定时FeSO4溶液放在锥形瓶中,KMnO4溶液放在酸式滴定管中,据滴定终点颜色变成紫色,停止滴定.
(3)过滤时,需要玻璃仪器有烧杯、漏斗、玻璃棒.从Fe(OH)3的悬浊液到最后的称量,需过滤、洗涤、灼烧、冷却、称量.
答案:(1)隔绝空气,防止被O2氧化 防止Fe2+水解
(2)①200毫升容量瓶 烧杯 玻璃棒 胶头滴管 量筒
②锥形瓶 酸式滴定管 紫
(3)①烧杯、漏斗、玻璃棒 ②A、B、F、E
11.(1)下列各种容器,通常分别用什么方法清洗?
①做过碘升华实验的烧杯__________________;
②长期存放过三氯化铁溶液的试剂瓶________;
③盛过苯酚的容器________________________.
(2)在实验室里做钠跟水反应的实验,实验目的是探究反应所得溶液的酸碱性.已备好的实验仪器有培养皿、滤纸、滴瓶(带滴管)、药匙.其中不需要的仪器是________;要圆满完成实验,还缺少的仪器有________.
解析:(1)仪器的洗涤关键是试剂的选择,选择试剂时,要考虑多方面的因素:第一,利用“相似相溶原理”把物质溶解,如(1)小题就是这样;第二,加入的物质与要洗涤的物质反应,生成易溶于水的物质也可达到目的,如(3)小题.经过简单分析(2)小题更容易得到答案.
(2)题中内含的解题要求是对单质钠的取用.实验室中的单质钠是较大块的固体,硬度较小,实验中用黄豆粒大小的钠块即可,切忌过大.取用钠块要用镊子而不用药匙,切割钠要在玻璃片上用小刀切割.
答案:(1)①先用酒精清洗,再用水洗
②先用盐酸清洗,再用水洗
③先用氢氧化钠溶液清洗,再用水洗
(2)药匙、培养皿 镊子、玻璃片、小刀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com