
题目列表(包括答案和解析)
(1)本专题在高考中的地位:化学基本概念是化学学习的基础,也是高考化学试题的重点考查对象之一,每年的高考化学试题中化学基本概念占有很大的比例。高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等基本概念的理解和辩折能力。而高考试题中的大题无论是基础型试题还是能力型试题,问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等基本化学用 语来表述答案。所以,熟练掌握化学用语、理解这类化学用语的含义非常重要,是学生能否得分的重要手段。
语来表述答案。所以,熟练掌握化学用语、理解这类化学用语的含义非常重要,是学生能否得分的重要手段。
(2)2011年高考考纲对化学基本概念这一块高考要求:
物质的组成和分类:
①了解分子、原子、离子、元素等概念的含义,初步了解原子团的定义。
②理解物理变化与化学变化的区别和联系。
③理解混合物和纯净物、单质和化合物、金属和非金属的概念。
④了解同素异形体的概念,注意其与同位素、同系 物、同分异构体等的区别。
物、同分异构体等的区别。
⑤理解酸、碱、盐、氧化物的概念及其相互联系。
化学用语
①熟记并正确书写常见元素的名称、符号、离子符号。
②熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学 式判断化合价。
③掌握原子结构示意图、分子式、结构式和结构简式的表示方法。
④理解质量守恒定律的含义,理解热反应方程式的含义。能正确的书写化学反应方程式、热反应方程式、电离方程式、离子方程式、电极方程式。
化学中的常用计量
①了解相对原子质量、相对分子质量的涵义。
②了解物质的量的单位--摩尔(mol),摩尔质量(g·mol-1)、气体摩尔体积(L·mol -1);理解物质的量浓度(mol·L-1)、阿伏加德罗常数;掌握物质的量与微粒(原
子、分子、离子等)数目、气 体体积(标准状况下)之间的相互关系。
体体积(标准状况下)之间的相互关系。
化学反应与能量
①掌握化学反应的四种基本反应类型:化合、分解、置换、复分解
②理解氧化还原反应,了解氧化剂和还原剂等概念。掌握重要得氧化剂、还原剂之间的常见反应。能判断氧化还原反应中电子转移的方向和数目。
了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热、中和热等概念。初步了解新能源开发。
溶液
①了解溶液、悬浊液、乳浊液、胶体的概念,区别及鉴别它们的方法。
②了解胶体的概念及其重要性质和应用。
③初步了解结晶、结晶水、结晶水合物、风化、潮解等概念
④了解溶液的组成、理解溶液中溶质的质量分数的概念。
(3)近3年高考试题全国卷统计分析
|
知识点 |
年份 |
考查情况 |
|
物质的组成 性质和分类 及化学用语 |
2010 |
全国I·7题·6分; 全国I·28题·综合考查; 全国II·28题·综合考查 |
|
2009 |
全国II.9题·6分 |
|
|
2008 |
全国I·8题·6分;全国II·8题·6分; |
|
|
化学中常 用计量和 分散系 |
2010 |
全国I·12题·6分;全国Ⅱ·11题·6分 |
|
2009 |
全国I·7题·6分;全国II·7题·6分 |
|
|
2008 |
全国II·11题·6分 |
|
|
氧化还原 反应 |
2010 |
全国Ⅱ·10题·6分 |
|
2009 |
全国I·8题·6分;全国II·6题·6分 |
|
|
2008 |
全国I·26;全国Ⅱ·12题·6分 |
|
|
离子反应 |
2010 |
全国I·8题6分 全国Ⅱ·6题·6分 全国卷13题6分 |
|
2009 |
全国I·6题·6分;全国II·13题·6分;全国II·29题·15分 |
|
|
2008 |
全国I·6题·6分;全国II·28·13分 |
|
|
化学反应 中的能量 变化 |
2010 |
全国Ⅱ·7题·6分 |
|
2009 |
全国II·11题·6分; |
|
|
2008 |
全国II·26 |
(4)高考命题趋向及高考命题展望
1、注重基础,把握传统热点。高考试题基本概念部分一直是高考的热点,考查形式以选择题为主,传统考查热点依旧是本届高考的热点,具体内容总结如下:
①、以发现新物质为背景,围绕同位素、同素异形体、同分异构体等概念考查。
②、常见的化学用语围绕电子式、原子结构示意图、分子式、结构式等形式考查。
③、离子方程式正误的判断、离子共存等形式,也可能在大题当中要求学生书写离子方程式或化学方程式的形式。
④、围绕阿伏伽德罗常数NA、气体的摩尔体积等内容考查。
⑤、围绕氧化还原反应的配平、计算电子转移,氧化剂还原剂的基本概念。
⑥、热反应方程式的书写、盖斯定律。
5. 硫磺、木炭和硝酸钾的混合物是我国的四大发明,意思是“着火的药”。现有火药样品248g(无其它杂质),燃烧后生成67.2L(标准状况下)气体和由K2CO3、K2SO4以及K2SO3组成的固体混合物,其中67.2L气体产物中CO和CO2占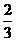 ,其余气体为N2。则火药中硫磺的物质的量为
,其余气体为N2。则火药中硫磺的物质的量为
A.0.5mol B.2mol C.2.5mol D.3mol
4. 分析下表,下列选项中错误的是
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7,K2=5.6×l0-11 |
A.NaCN + H2O + CO2(少量) =HCN + NaHCO3
B.0.1mol·L-1的醋酸溶液中加入水或加入冰醋酸均可使平衡向电离方向移动
C.等物质的量浓度的Na2CO3和NaCN溶液,后者溶液中水的电离程度大
D.等pH的上述3种酸溶液,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积最少
3.下表中对离子方程式的评价合理的是 ( )
|
选项 |
化学反应及离子方程式 |
评价 |
|
A |
NaClO溶液中通入少量的SO2: ClO-+H2O+SO2=Cl-+SO42-+2H+ |
错误,碱性介质中不可能生成H+ |
|
B |
酸性高锰酸钾溶液和H2O2制取少量O2: 4MnO4-+4H2O2+12H+=4Mn2++7O2↑+10H2O |
正确 |
|
C |
NH4Al(SO4)2溶液中滴入几滴NaOH溶液: NH4++OH-=NH3·H2O |
错误,产物中还有少量Al(OH)3生成 |
|
D |
用惰性电极电解MgCl2溶液: 2Mg2++2H2O  2Mg+O2↑+4H+ 2Mg+O2↑+4H+ |
正确 |
2. 有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为
有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为 。下列关于两种有机化合物A和B的说法中错误的是
。下列关于两种有机化合物A和B的说法中错误的是
A.有机物A分子所有碳原子均在同一平面上
B.有机物B的化学式为C6H8
C.有机物A的二氯取代产物有4种
D.等质量的A和B完全燃烧耗氧量不同
1.碳酸气的主要成分是CO2,CO2是造成温室效应的罪魁祸首。下列表述中正确的是
A.CO2的电子式为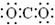
B.14C16O2分子中质子数之和和中子数之和相等
C.标准状况下CO2气体的密度约为1.96g/L
D.反应2Mg+CO2 2MgO+C ΔH<0不可能自发进行
2MgO+C ΔH<0不可能自发进行
5. 化合物X是一种作用于中枢神经系统的药物,化合物Y是合成抗高血压药物维普罗斯托(Viprostol)的中间体。下列关系这2种有机物的说法中不正确的是
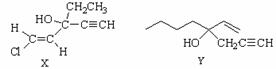
A.有机物X分子中所有碳原子不可能共面
B.2种有种物都能发生氧化反应和还原反应
C.2种有机物在NaOH醇溶液中均能发生消去反应
D.2种有机物均不存在属于酚类的同分异构体
第三组
4. 今有X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,最外层电子数之和为10,下列说法正确的是
A.Y的最高价氧化物对应的水化物一定是强碱
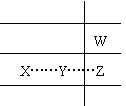 B.Z一定位于ⅦA
B.Z一定位于ⅦA
C.若X、Y、W形成的化合物为XYW2,则其水溶液显碱性
D.X与足量的W反应生成的化合物为X2W
3.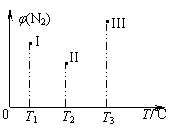 在容积均为500mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入1 mol N2和2.5 mol
H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2 + 3H2
在容积均为500mL的I、Ⅱ、Ⅲ三个密闭容器中分别充入1 mol N2和2.5 mol
H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2 + 3H2 2NH3 △H<0。实验测得反应均进行到t min 时N2的体积分数如下图所示。下列说法正确的是
2NH3 △H<0。实验测得反应均进行到t min 时N2的体积分数如下图所示。下列说法正确的是
A.当v (H2)=3v (N2)时,可以说明三个容器中的反应达平衡状态
B.在tmin时,一定达化学平衡状态的是II和III
C.在tmin时测得c(N2)III=1mol·L-1,若再向III中充入1.5 mol N2和1 mol NH3,H2的转化率不变
D.三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小
2.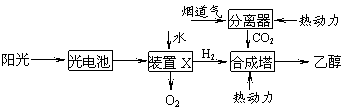 下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是
下图是一种以烟道气为原料合成乙醇的工作原理示意图。下列说法正确的是
A.该流程图中只存在4种形式的能量转化
B.装置X中阳极反应式为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.本工艺减轻了烟道气中CO2对环境的压力,绿色化学的成分高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com