
题目列表(包括答案和解析)
6、反应热
[方法指导]
由于能源问题已成为社会热点,有关能源的试题也将成为今后命题的重点。在复习过程中应以能源问题为切入点,从不同的角度设问,形成跨学科的综合试题,来全面考查学生的基础知识和运用多学科知识分析问题和解决实际问题的能力。除此之外,今后高考命题的趋势是:考查反应热的内容将不断拓宽,难度有所提高,形势也会更加灵活。加强盖斯定律的教学也将是复习的重点。
[知识网络]
化学反应中的能量变化


例7(全国卷11).已知:HCN(aq)与NaOH(aq)反应的 H = -12.1kJ /mol;HCl(aq)与NaOH(aq)反应的
H = -12.1kJ /mol;HCl(aq)与NaOH(aq)反应的 H = -55.6kJ/
H = -55.6kJ/ mol。则HCN在水溶液中电离的
mol。则HCN在水溶液中电离的 H等于( )
H等于( )
A.-67.7 kJ /mol B.-43.5kJ /mol C.+43.5 kJ/ mol D.+67.7 kJ/ mol
点评:掌握反应热、燃烧热、中和热基本概念和应用盖斯定律是本节知识的主要考点
二轮复习由于时间比较紧,我们切记不要漫无目的四处出击,要找重点找学生学习的盲点弱点。复习要以大纲和教材为依据,以高考的热点和发展趋势为方向,突出重点,突破难点,高考当中一定会取得实效。
2. 性质强弱规律

例6. 亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
点评:熟悉常见元素的化合价,结合氧化还原反应的概念。
1. 了解基本概念
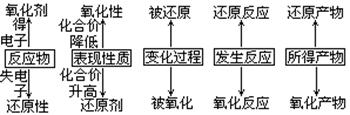
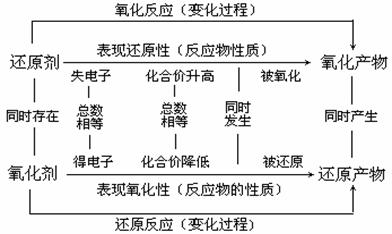
3、 引导学生学会解决有关氧化还原反应的计算方法和技巧;可根据电子守恒,依据氧化剂得电子总数等于还原剂失电子总数的关系,列出守恒关系式求解,从试题的变化趋势看,有一类题目是已知参加反应的氧化剂与还原剂的质量比,计算确定产物。要注意参 加反应的量不一定完全是被氧化,或被还原;或一种物质由于歧化,有一部分被氧化,而另一部分被还原;即部分氧化或部分还原的计算。
加反应的量不一定完全是被氧化,或被还原;或一种物质由于歧化,有一部分被氧化,而另一部分被还原;即部分氧化或部分还原的计算。
[知识网络]
2、 讲清氧化性和还原性强弱的比较以及判断强弱的方法。(要求学生掌握常见的氧化剂和还原剂)
1、 理清几组重要概念及其之间的关系
5、氧化还原反应
[方法指导]
3.关于阿伏加德罗常数的理解与综合应用
阿伏加德罗常数问题主要有:
(1)一定质量的物质中所含原子数、电子数,其中考查较多的是H2O、N2、O2、H2、NH3、P4等。
(2)一定体积的物质中所含原子数、分子数,曾考过的物质有Cl2、NH3、CH4、O2、N2、CCl4、C8H10等
(3)一定量的物质在化学反应中的电子转移数目,曾考过的有Na、Mg、Cu等。
(4)一定体积和一定物质的量浓度溶液中所含电解质离子数、分子数,如稀硫酸、硝酸?镁等。
(5)某些典型物质中化学键数目,如SiO2、Si、CH4、P4、CO2等。
(6)细微知识点(易出错):状态问题,水、CCl4、C8H10等在标准状况下为液体或固体;D2O、T2O、18O2等物质的摩尔质量;Ne、O3、白磷等物质分子中原子个数等。
例5(2010年江苏5)设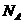 为阿伏伽德罗常数的值,下列叙述正确的是
为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下, 的
的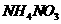 溶液中氮原子数为0.2
溶液中氮原子数为0.2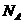
B.1 羟基中电子数为10
羟基中电子数为10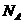

C.在反应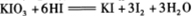 中,每生成3
中,每生成3
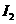 转移的电子数为6
转移的电子数为6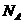
D.常温常压下,22.4L乙烯中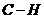 键数为4
键数为4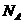
点评:涉及阿伏加德罗常数(NA)的问题每年高考都会考查,重现率为100%。在解答这类题目时,要认真审题,特别注意试题中一些关键性的字、词,留心有无“陷阱”。
解题思路是:在正确理解有关概念的基础上,将各物质的质量、气体的体积、溶液的浓度等转化为指定粒子的物质的量,然后进行判断。在解题时还应注意下面一些细微的知识点:如常温与标准状况,羟基与氢氧根等区别。
2.物质的量和其它物理量之间的关系:
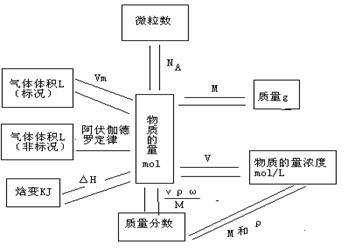
1. 基本概念和重要定律
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com