
题目列表(包括答案和解析)
5.(1)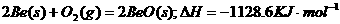
(2)
5.铍是一种高效率的火箭燃料,铍在燃烧时能释放出巨大的能量:每千克铍完全燃烧放出的
热量为62700kJ。
(1)写出铍燃烧的热化学方程式: 。
(2)写出氧化铍与盐酸反应的离子反应方程式: 。
答 案:1.C 2.A 3.B 4.C
4.在25℃、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750mL中充分反应,测
得反应放出x kJ热量。在该条件上,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应
放出y kJ热量。则CO2与aOH溶液反应生成NaHCO3的热化学方程式是 ( C )
A.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(4x-y) kJ·mol-1
D.2CO2(g)+NaOH(1) === NaHCO3(1);△H=-(8x-2y) kJ·mol-1
3.同温同压下,下列各组热化学方程式中,△H1﹤△H2的是 ( )
A.
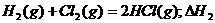
B.
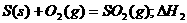
C.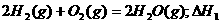

D.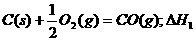

2.(2008海南8)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A、(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C、(4c+12b-4a-5d)kJ·mol-1 D、(4a+5d-4c-12b)kJ·mol-1
要使分解反应能自发的进行:⊿G < 0,即T〉⊿H /⊿S
/⊿S ,对于同类物质而言,⊿S
,对于同类物质而言,⊿S 基本相同,故分解温度将随⊿H正值的增大而升高。利用波恩哈伯循环及晶格能公式等得出
基本相同,故分解温度将随⊿H正值的增大而升高。利用波恩哈伯循环及晶格能公式等得出
 =-8568
=-8568 由于r(CO32-)>r(O2-),
由于r(CO32-)>r(O2-),
故 >0
>0
结论:碱土金属阳离子半径增大时,其碳酸盐分解反应的⊿H 也增大,这一主族从上到下,离子半径增大,所以分解反应热也逐渐增大,碳酸盐的稳定性也逐渐增大。即MgCO3<CaCO3。
也增大,这一主族从上到下,离子半径增大,所以分解反应热也逐渐增大,碳酸盐的稳定性也逐渐增大。即MgCO3<CaCO3。
变式训练:
1.(2010新课标全国11)己知: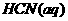 与
与 反应的⊿H=-12.1KJ/mol;HCl(aq)与
反应的⊿H=-12.1KJ/mol;HCl(aq)与 反应的⊿H=-55.6KJ/mol。则
反应的⊿H=-55.6KJ/mol。则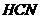 在水溶液中电离⊿H等于( )
在水溶液中电离⊿H等于( )
A.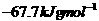 B.
B.
C. D.
D. 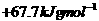 C
C
由前述可知:△H与始态终态有关而与途径无关。所以盖斯定律为:不管化学反应是一步完成或分几步完成,其反应热是相同的。如:
例4:(2010广东9)在298K、100kPa时,已知:2 ;⊿
;⊿
 ;⊿
;⊿
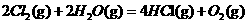 ;⊿
;⊿
则⊿ 与⊿
与⊿ 和⊿
和⊿ 间的关系正确的是( )
间的关系正确的是( )
A .⊿ =⊿
=⊿ +2⊿
+2⊿ B ⊿
B ⊿ =⊿
=⊿ +⊿
+⊿
C. ⊿ =⊿
=⊿ -2⊿
-2⊿ D. ⊿
D. ⊿ =⊿
=⊿ - ⊿
- ⊿
解 析:
由盖斯定律知:A正确
键能是气态基态原子形成1mol化学键释放的最低能量。例如,形成1molH-H键释放的最低能量为436.0kJ、断开1molCl-Cl键吸收242.7KJ的能量,这些就是相应化学键的键能,通常取正值。故由上述知:△H约等于反应物的总键能与生成物的总键能之差。如下表
例3:(2010重庆12)已知 (g)+
(g)+ (l)=2
(l)=2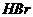 (g);△H=-72KJ/
(g);△H=-72KJ/ ,蒸发1
,蒸发1
 (l)需要吸收的能量为30KJ,其它相关数据如下表:
(l)需要吸收的能量为30KJ,其它相关数据如下表:
|
|
 (g) (g) |
 (g) (g) |
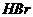 (g) (g) |
1 分子中的化学键断裂时需要吸收的能量/ KJ 分子中的化学键断裂时需要吸收的能量/ KJ |
436 |
a |
369 |
则表中a为( )
A 404 B 260 C 230 D200
解 析:
由已知得:Br2(l)=Br2(g) H=+30KJ/mol,则H2(g) + Br2(g) = 2HBr(g);H= -102KJ/mol。据△H约等于反应物的总键能与生成物的总键能之差知:436+a-2×369=-102;a=―200KJ,D项正确。
在热化学方程式中△H与各物质的计量数有何联系?为什么单位为KJ/mol或J/mol?这要从反应进度说起。
对于一个反应
N2(g)
+ 3H2(g)  2NH3(g)
2NH3(g)
各物质计量数: 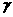 1=-1
1=-1 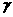 2=-3
2=-3
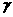 3=2
3=2
反应(转化)的各物质的n(mol): n1 n2 n3
则: ξ= =
=  =
=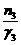 (单位:mol)
(单位:mol)
H是体系的容量性质,故△H必与ξ成正比,△H=△rH /ξ, △rH
/ξ, △rH 的单位为J或KJ,故△H的单位为KJ/mol或J/mol.。也就是说△H为ξ=1mol时的反应热。
的单位为J或KJ,故△H的单位为KJ/mol或J/mol.。也就是说△H为ξ=1mol时的反应热。
例2:(2010浙江12)下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C. 氯化镁溶液与氨水反应:
D. 氧化铝溶于NaOH溶液: 3
3
解 析:
A、B考查热化学方程式的书写。热化学方程式的书写问题由:聚集状态、系数(ξ=1mol时)、系数与反应热数值对应、反应热单位、可逆反应的反应热等内容构成。答案D
热化学上将体系内部所有能量之和称为热力学能。热力学能的增加等于体系从环境中吸收的热加上环境对体系所做的功---热力学第一定律。当体系只做体积功而没做其它功时:Qp=△H;当体系不做体积功而只做电功时:Q≠△H。故中学化学教材上反应热的定义为:一定压强下,化学反应所放出或吸收的热量。也就是说△H为压强一定,温度一定(即物质的状态一定)只做体积功时的热效应。因此,在书写热化学方程式时必须注明物质的聚集状态及用△H 表示Qp,且当体系吸热为正、放热为负。
例1:(09重庆12)下列热化学方程式书写正确的是( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g);△H=-296.8kJ/mol(反应热)
D. 2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
解 析:
A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,A项错误;中和反应是放热反应,△H应小于0,B项错误;热化学反应方程式要注明物质在反应时的状态,D项错误;答案C正确。考查燃烧热以及热化学方程式的书写及正误判断。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com