
题目列表(包括答案和解析)
13.(1)在下面元素周期表中全部是金属元素的区域为____.
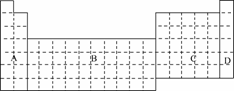
a.A b.B
c.C d.D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是________.
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜;乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是________(填名称),可以验证该结论的实验是
________.
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞试剂
d.比较这两种元素的气态氢化物的稳定性
解析:(1)据元素周期表、元素周期律知识可知:A区为金属元素、非金属元素共存区;B区为过渡元素,全部为金属元素;C区为金属元素、非金属元素共存区;D区为0族元素或稀有气体元素.
(2)碳、氢两种元素均可形成无机物、有机物,且碳、氢是形成有机物的主要元素,但是在无机物中,碳形成的化合物不如氢形成的化合物多.
(3)据题意可知:甲为Al元素,乙为Mg元素;同周期元素随原子序数的递增,金属性逐渐减弱,故Mg的金属性较强,验证该结论的依据是判断元素金属性强弱的规律:金属单质与H2O或酸反应放出H2的难易程度.
答案:(1)b (2)H (3)①见下表中 ②镁 ③bc

12.A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大.A、C可形成原子个数比分别为1∶1和2∶1的两种化合物.A与B能形成一种使湿润石蕊试纸变蓝的气体X,A与D能形成酸性气体Y.A、B、C能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)D的元素符号________,X跟Y反应的化学方程式
________________________________________.
(2)用化学用语解释A、B、C形成的化合物水溶液呈弱酸性的原因:
__________________________________.
(3)铋(Bi)跟D元素能形成化合物(BiD3),其水解生成难溶于水的BiOD.
①BiD3水解反应的化学方程式为________________________________.
②把适量的BiD3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因
______________________________________________.
③医药上把BiOD叫做“次某酸铋”,分析这种叫法是否合理?________.若认为不合理,请说明理由;若认为合理,此空可不作答.___________________________________.
解析:A与B能形成一种使湿润石蕊试纸变蓝的气体X,则X为NH3,又A、B原子序数依次增大,A为氢,B为氮.A、C可形成原子个数比分别为1∶1和2∶1的两种化合物,且C的原子序数比A和B大,则C为氧.由A与D能形成酸性气体Y,A、B、C、D分别属于三个不同的周期且原子序数依次增大,可推出D为氯.
(2)NH4NO3溶液因NH水解而显酸性.
(3)①据信息可知BiCl3水解的方程式为BiCl3+H2OBiOCl+2HCl.
②因盐酸抑制了BiCl3的水解,故BiCl3溶于含少量盐酸的水中能得到澄清溶液.
③分析BiOCl中Cl的化合价可知Cl显-1价,因此这种叫法不合理.
答案:(1)Cl NH3+HCl===NH4Cl
(2)NH+H2ONH3·H2O+H+
(3)①BiCl3+H2OBiOCl+2HCl
②盐酸抑制BiCl3水解
③不合理 BiOCl中的Cl为-1价,不是+1价
11.(2009·安徽合肥高三质检)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质 |
|
B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
|
C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
|
D |
其氢氧化物和氧化物都有两性,与C同周期 |
|
E |
与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C________,E________.
(2)写出A、B、C形成的化合物的电子式________.
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)______________________________________.
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式:
____________________________________.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:
____________________________________.
③B、C元素形成的化合物与A2B反应的两个化学方程式:
______________________________________.
解析:根据题目信息可推断:A为氢,B为氧,C为钠,D为铝,E为氯.
(3)三者具有相同的核外电子排布式,核电荷数越大,离子半径越小,即离子半径:r(O2-)>r(Na+)>r(Al3+).
(4)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Al+2OH-+2H2O===2AlO+3H2↑
③Na、O可形成Na2O和Na2O2,不要漏写.
答案:(1)钠 氯 (2)Na+[····H]-
(3)r(O2-)>r(Na+)>r(Al3+)
(4)①Cl2+2NaOH===NaCl+NaClO+H2O
②2Al+2OH-+2H2O===2AlO+3H2↑
③2Na2O2+2H2O===4NaOH+O2↑
Na2O+H2O===2NaOH
10.(2009·滨州一模)下图中a、b、c、d、e为周期表前四周期的部分元素,下列叙述正确的是
( )
|
|
|
|
|
a |
|
|
|
b |
|
|
|
c |
|
|
d |
|
|
|
e |
|
|
|
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素的性质最稳定
C.b、d气态氢化物溶于水,溶液的酸性:b>d
D.e元素最高价氧化物的水化物和不同量的氢氧化钠反应,可能生成三种盐
解析:题干中明确指出a、b、c、d、e为周期表前四周期的元素,因此根据元素周期表的结构可确定a为He,b为O,c为Si,d为Cl,e为As.对于选项A,O元素除0价外,还有-2价、-1价、+2价等,A错;根据核外电子排布特点,5种元素中最稳定的元素应是稀有气体He,B错;b、d气态氢化物分别为H2O和HCl,显然C错;e元素最高价氧化物的水化物为H3AsO4,其性质应和H3PO4相似,是一种三元酸,能和碱反应生成两种酸式盐和一种正盐.
答案:D
9.(2010·威海月考)我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题.关于锂的叙述不正确的是
( )
A.锂是较轻的金属
B.LiOH的碱性比NaOH弱
C.锂的化学性质不如钠活泼
D.Na可以从Li的盐溶液中将Li置换出来
解析:锂比煤油的密度都小,属轻金属,正确;Li的金属性比钠弱,故碱性:LiOH<NaOH,故B、C均正确;因钠能与水剧烈反应,故Na不能将Li从其盐溶液中置换出来,D不正确.
答案:D
8.(2009·山东潍坊质检)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
( )

A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性W比Z弱
C.Z的单质与氢气反应较Y剧烈
D.X、Y形成的化合物都易溶于水
解析:Y原子的最外层电子数是内层电子数的3倍,Y为O.X、Z、W分别为N、S、Cl.这四种元素中没有碳,不能组成有机化合物,A项正确.W的最高价氧化物对应水化物为HClO4,Z的最高价氧化物对应水化物为H2SO4,HClO4酸性比H2SO4强,B项错.Cl2与氢气反应较S剧烈,C项错.X、Y可以形成不溶于水的化合物,如NO,D项错误.
答案:A
7.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
( )
A.x+2 B.x+4
C.x+8 D.x+18
解析:元素周期表有7个周期,16个族,主族是长短周期共同组成的族,同一主族的两元素原子序数差值是有规律的.同主族相邻两周期原子序数差值可能为2、8、18、32等,显然上下两周期两元素的原子序数的差值不可能为4.
答案:B
6.某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a gHmX中所含质子的物质的量是
( )
A.(A-N+m) mol
B.(A-N) mol
C.(A-N) mol
D.(A-N+m) mol
解析:HmX的相对分子质量为A+m,每分子中含质子个数为(A-N+m)个,故a gHmX中含质子的物质的量为(A-N+m) mol.
答案:A
5.下列关于卤素(从F→I)的说法正确的是
( )
A.单质的颜色逐渐加深
B.气态氢化物的稳定性逐渐增强
C.气态氢化物水溶液的酸性逐渐减弱
D.与水反应,自身氧化还原剧烈程度为F2>Cl2>Br2>I2
解析:卤族元素从F→I,单质的颜色逐渐加深,非金属性减弱,则气态氢化物的稳定性减弱,而水溶液的酸性逐渐增强,与水反应时,F2和H2O剧烈反应,F2是氧化剂,H2O是还原剂,而非F2的自身的氧化还原反应.
答案:A
4.(2009·山东实验中学诊断)2007年10月24日,“嫦娥一号”开始了它的探月历程,它的一项重要任务是探测月球表面土壤里的一种非常有用的资源--可控核聚变的原料3He,3He是一种安全高效而又清洁无污染的物质.据统计,月球上的3He可以满足人类1万年以上的供电需求,月球土壤中的3He含量可达500万吨.关于3He的叙述正确的是
( )
A.3He和4He两种核素互为同素异形体
B.3He和4He两种核素互为同位素
C.核聚变时,原子核发生了变化,发生了化学反应
D.在3He中存在:质子数=中子数=核外电子数
解析:3He和4He为氦元素的两种不同原子,互为同位素,A错,B对;核聚变是物理现象,化学变化中原子的种类和数目不变,C错;3He中质子数=核外电子数=2,中子数=1,D错.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com