
题目列表(包括答案和解析)
7.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是
( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
解析:根据沉淀转化一般规律:溶解度小的沉淀易转化为溶解度更小的沉淀,故由反应(1)知,溶解度CuCO3>Cu(OH)2,由反应(2)知Cu(OH)2>CuS.
答案:A
6.(2009·山东模拟)已知25℃时,电离常数Ka(HF)=3.6×10-4 mol/L.溶度积常数Ksp(CaF2)=1.46×10-10.现向1 L 0.2 mol/L HF溶液中加入1 L 0.2 mol/L CaCl2溶液.则下列说法不正确的是
( )
A.25℃时,0.1 mol/L HF溶液中pH>1
B.Ksp(CaF2)随温度的变化而变化
C.氟化钙和氟化氢都是弱电解质
D.该体系中有CaF2沉淀产生
解析:因为HF是弱电解质,所以0.1 mol/L HF溶液中pH>1,氟化钙是难溶的强电解质,故C项符合题意.
答案:C
0.005 mol 0.02 mol
n(OH-) 余=1×0.05 mol-0.02 mol=0.03 mol
c(OH-)==0.3 mol/L
c(H+)==3.3×10-14 mol/L
pH=13.5
此时溶液中主要以CrO形式存在.
答案:C
5. 向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO),其平衡关系如下:
Cr3++3OH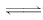
 Cr(OH)3
Cr(OH)3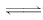
 CrO+H++H2O
CrO+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05 mol/L的Cr2(SO4)3溶液50 mL中加入1.0 mol/L的NaOH溶液50 mL,充分反应后,溶液中可观察到的现象为
( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
解析:c(Cr3+)=0.1 mol/L
n(Cr3+)=0.1 mol/L×0.05 L=0.005 mol
Cr3+ + 4OH-===CrO+2H2O
4.(2009·海市模拟)下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
( )
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水 ,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
解析:AgCl固体在溶液中达到溶解平衡后,溶解与沉淀速率相等,但不为0,A项正确;AgCl难溶于水,但溶解的部分电离出Ag+和Cl-,B项错误;一般来说,升高温度有利于固体物质的溶解,C项正确;向AgCl沉淀中加入NaCl固体,增大了Cl-浓度,促使溶解平衡向左移动,降低了AgCl的溶解度,D项正确.
答案:B
3.已知一些银盐的颜色及溶解度数值如下:
|
化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
|
颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
|
溶解度/g |
1.5×10-4 |
7.1×10-7 |
2.1×10-7 |
1.3×10-16 |
4.3×10-2 |
测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是
( )
A.KBr B.KI
C.K2S D.K2CrO4
解析:指示剂在作用时,应在反应刚好完成,所加过量试剂会与指示剂作用生成不同现象来进行判断.本题应在Ag+和Cl-生成AgCl沉淀后,再生成其他沉淀.所以本题指示剂的溶解度应比AgCl大.
答案:D
2.下列各操作中,不发生“先沉淀后溶解”现象的是
( )
①向饱和Na2CO3溶液中不断通入过量的CO2气体
②向Fe(OH)3胶体中逐滴滴入过量的稀H2SO4
③向AgI胶体中逐滴加入过量的稀盐酸
④向石灰水中通入过量的CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A.①③⑤ B.①②③⑤
C.②④ D.全部
解析:①只发生反应Na2CO3+CO2+H2O===2NaHCO3(析出NaHCO3);②中Fe(OH)3先聚沉后被H2SO4溶解;③中 AgI聚沉但不溶解;④中先生成CaCO3沉淀后溶解;⑤中只生成H2SiO3沉淀.
答案:A
1.在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐变为黄色沉淀.通过这个实验可以说明的是
( )
A.I-的还原性比Cl-的强
B.Cl-的半径比I-的小
C.AgI的溶解度比AgCl的大
D.实验过程中,溶解平衡AgCl(s)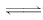 Ag+(aq)+Cl-(aq)不断向右移动
Ag+(aq)+Cl-(aq)不断向右移动
解析:白色沉淀转化成黄色沉淀,说明在振荡过程中氯化银转化成碘化银,所以氯化银的溶解平衡AgCl(s)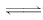 Ag+(aq)+Cl-(aq)不断向溶解方向移动.
Ag+(aq)+Cl-(aq)不断向溶解方向移动.
答案:D
22.(8分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯:
已知:C3H8(g)===CH4(g)+HCCH(g)+H2(g)
ΔH1=+156.6 kJ/mol
CH3CHCH2(g)===CH4(g)+HCCH(g)
ΔH2=+32.4 kJ/mol
则相同条件下,反应C3H8(g)===CH3CHCH2(g)+H2(g)的ΔH=________kJ/mol.
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐.电池反应方程式为________;放电时,CO移向电池的________(填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol/L.若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO+H+的平衡常数K1=________.(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO)(填“>” 、“=”或“<”),原因是____________________(用离子方程式和必要的文字说明).
解析:(1)根据盖斯定律,将两反应式相减得到:
C3H8(g)===CH3CH=CH2(g)+H2(g)
ΔH=+124.2 kJ/mol.
(2)该燃料电池的电解质是熔融碳酸盐,电池反应方程式是C3H8燃烧的方程式.放电时,阴离子向负极移动.
(3)根据平衡常数K1=,
c(H+)=c(HCO)=2.5×10-6 mol/L,
c(H2CO3)=1.5×10-6 mol/L.
可求出K1=4.2×10-7mol/L.
(4)由NaHCO3溶液的pH>8得HCO的水解程度大于电离程度.
答案:(1)124.2
(2)C3H8+5O2===3CO2+4H2O 负
(3) 4.2×10-7 mol/L
(4)> HCO+H2O
 CO+H3O+(或HCO
CO+H3O+(或HCO
 CO+H+)、HCO+H2O
CO+H+)、HCO+H2O
 H2CO3+OH-, HCO的水解程度大于其电离程度
H2CO3+OH-, HCO的水解程度大于其电离程度
21.(8分)在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10-a mol/L, c(OH-)=10-b mol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw=________.
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________.
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________.
解析:(1)该温度下:
KW=c(H+)·c(OH-)=10-a×10-b=10-(a+b)
=10-12>10-14,故T℃>25℃.
(2)据第①组可计算:
Ba(OH)2溶液中c(H+)水=1×10-8 mol/L,
故c(OH-)= mol/L=1×10-4 mol/L=10-b mol/L
∴b=4, c[Ba(OH)2]=×10-4 mol/L=5×10-5 mol/L
(3)据题意知n(SO)总=n[Ba(OH)2]=3 L×5×10-5 mol/L=1.5×10-4 mol
据恰好反应时知
c(OH-)过=×==10-5 mol/L
解得c(H+)=1×10-4 mol/L, pH=4, n(Na2SO4)=n(SO)总-n(H2SO4)=1.5×10-4 mol-×10-4 mol×1 L=1×10-4 mol,所以c(Na2SO4)=1×10-4 mol/L.
答案:(1)大于 1×10-12 (2) 4 5×10-5 mol/L (3)4 1×10-4 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com