
题目列表(包括答案和解析)
2.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
( )
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
解析:对于溶质物质的量浓度相同的溶液,水解后溶液的酸碱性取决于盐的组成性质,强碱弱酸盐水解呈碱性,强酸弱碱盐水解呈酸性,强酸强碱盐不水解,因此,Na2CO3、NaHCO3溶液显碱性,NaCl溶液呈中性,NH4Cl溶液显酸性,A、B错误;(NH4)2SO4、NH4Cl溶液显酸性,且前者NH浓度更大,H+浓度更大,pH较小,NaNO3溶液呈中性,Na2S溶液显碱性,故C正确D错误.
答案:C
1.下列离子方程式中,属于水解反应的是
( )
A.HCOOH+H2O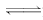 HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O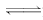 HCO+H+
HCO+H+
C.CO+H2O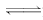 HCO+OH-
HCO+OH-
D.HS-+H2O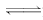 S2-+H3O+
S2-+H3O+
解析:A、D项是电离方程式,B项是CO2溶于水后的电离过程,C项正确.
答案:C
13.水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)、Pb(OH),各形态的浓度分数α随浓度pH变化的关系如下图所示:
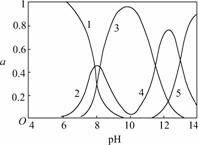
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH),5表示Pb(OH)]
(1)Pb(NO3)2溶液中,________2( 填“>”“=” 或“<”);往该溶液中滴入氯化铵溶液后,增加,可能的原因是____________________.
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有________,pH=9时主要反应的离子方程式为____________________.
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/mg/L |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/mg/L |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________________.
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+E2Pb(s)+2H+.
则脱铅的最合适pH范围为________(填代号).
A.4-5 B.6-7
C.9-10 D.11-12
解析:(1)Pb2+易水解,Pb2+与Cl-结合成微溶物PbCl2.
(2)根据图中曲线可看出在pH=8时溶液中铅元素除Pb2+和Pb(OH)+外,还有Pb(OH)2,但题目要求回答阳离子.
(3)要看去除效果的好坏不要只看处理后剩余的多少,也不能只看去除了多少,而应看去除的比率,除Pb2+外,当属Fe3+去除比率最高.
(4)据图观察和方程式判断,c(H+)过大,不利用沉淀生成,而c(OH-)过大Pb2+则会以其他形式存在,在pH=6时,c(Pb2+)最大,有利于平衡右移.
答案:(1)> Pb2+与Cl-反应,Pb2+浓度减小
(2)Pb2+、Pb(OH)+、H+ Pb(OH)++OH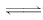
 Pb(OH)2
Pb(OH)2
(3)Fe3+ (4)B
1.(2)减小 (3)0×10-6 mol/L
(4)①能;Ksp(AgY)=1.0×10-12>Ksp(AgZ)=8.7×10-17
②能;当溶液中c(X-)>1.8×10-4 mol/L时,AgY开始向AgX的转化,若要实现AgY向AgX的完全转化,必须保持溶液中的c(X-)>1.8×10-4 mol/L
12.(2009·青岛调研)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡.当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似).
如:AgX(s)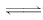
 Ag+(aq)+X-(aq)
Ag+(aq)+X-(aq)
Ksp(AgX)===c(Ag+)·c(X-)=1.8×10-10
AgY(s)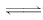
 Ag+(aq)+Y-(aq)
Ag+(aq)+Y-(aq)
Ksp(AgY)===c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)
 Ag+(aq)+Z-(aq)
Ag+(aq)+Z-(aq)
Ksp(AgZ)===c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为________________.
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”、“减小”或“不变”).
(3)在25℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________.
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:________.
②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项.
若不能,请简述理由:________________.
若能,则实验转化的必要条件是______________________________.
解析:(2)由于AgY比AgX更难溶,则向AgY的饱和溶液中加入AgX固体,发生沉淀的转化,AgX(s)+Y-(aq)===AgY(s)+X-(aq),则c(Y-)减小.
(3)25℃时,AgY的Ksp=1.0×10-12,即溶液达到饱和时,c(Ag+)=c(Y-)=1.0×10-6 mol/L,而将 0.188 g AgY溶于100 mL水中,形成的为饱和溶液(溶质还有未溶解的),则c(Y-)=1.0×10-6 mol/L.
(4)由于Ksp(AgZ)<Ksp(AgY),可以实现AgY向AgZ的转化.在(3)中,c(Ag+)=1.0×10-6 mol/L,当c(X-)>1.8×10-4 mol/L时,即可由AgY向AgX的转化.
答案:(1)S(AgX)>S(AgY)>S(AgZ)
0.50 mol/L HCl为稀盐酸,因有Cl-,抑制了PbCl2电离,故PbCl2在0.5 mol/L HCl中的溶解度小于纯水中的,故B正确.
因随盐酸浓度增大,PbCl2浓度逐渐增大,可知PbCl2与浓盐酸生成了难电离的阴离子,故C正确.
PbCl2能溶于稀盐酸,也能溶于食盐水,D正确.
答案:(1) Zn2++4OH-===[Zn(OH)4]2- (2)10-17 (3)8.0<pH<12.0 (4)A、B、C、D
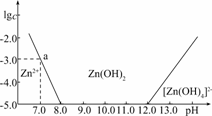
11.(2009·广东韶关月考)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为________________.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=______________.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是________.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表 :
|
c(HCl) (mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
103c(PbCl2) (mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
解析:(1)向ZnCl2中加入足量NaOH溶液,即OH-过量,由图象知Zn2+与OH-最终生成[ZN(OH4)]2-.
(2)由Zn(OH)2(s)
 Zn2+(aq)+2OH-(aq)
Zn2+(aq)+2OH-(aq)
知:Ksp[Zn(OH)2]=c(Zn2+)·[c(OH-)]2
将a点数据代入,可得:Ksp=(10-3)·(10-7)2=10-17
(3)由图象可知,当8.0<pH<12.0时,溶液中的Zn2+可与OH-结合为Zn(OH)2沉淀.
(4)由表知,开始PbCl2浓度由5.10降至4.91,又升至5.21,随后逐渐增大,故A正确.
10.将100 mL 0.1 mol/L的AgNO3溶液加入足量的NaCl和NaF的混合溶液中,产生1.435 g沉淀,则下列说法正确的是
( )
A.产生的沉淀为AgCl
B.产生的沉淀为AgF
C.产生的沉淀为AgF和AgCl的混合物
D.溶度积:AgF小于AgCl
解析:由NaCL和NaF混合液足量可知,1.435 g沉淀只能是AgCl或AgF中更难溶的1种,由其物质的量为0.01 mol可知,应为AgCl,从而可知Ksp(AgF)>Ksp(AgCl).
答案:A
9.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)
 Ca2+(aq)+2OH-(aq).下列说法正确的是
Ca2+(aq)+2OH-(aq).下列说法正确的是
( )
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
解析:向平衡体系中加入CaO,CaO与H2O反应使c(Ca2+)和c(OH-)都增大,平衡向左移动,由于温度不变,Ksp不变,所以当c(Ca2+)和c(OH-)减小至与原平衡相等时达到新的平衡,c(Ca2+)、c(OH-)未变,pH不变[但n(Ca2+)、n(OH-)减小了,Ca(OH)2的量增大了];给溶液加热,Ca(OH)2的溶解度随温度升高而减小,所以又会有少量Ca(OH)2析出,c(OH-)减小,pH减小;加入 Na2CO3溶液,部分Ca(OH)2转化为CaCO3,固体质量增加;加入NaOH(s),平衡左移,Ca(OH)2固体质量增加.
答案:C
8.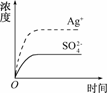 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图所示[饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L].若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是
已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图所示[饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L].若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是
( )
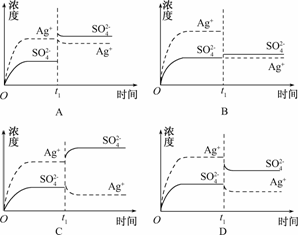
解析:在饱和Ag2SO4溶液中,c(Ag+)=0.034 mol/L,则c(SO)=0.017 mol/L,加入100 mL 0.020 mol/L Na2SO4溶液后,c(Ag+)=0.017 mol/L, c(SO)==0.0185 mol/L,
[c(Ag+)]2·c(SO)=5.3×10-6<2.0×10-5,不会析出Ag2SO4沉淀,则c(Ag+)==0.017 mol/L,B正确.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com