
题目列表(包括答案和解析)
2.(2009·山东济南模拟)美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构--Al13和Al14. 已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
( )
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
解析:Al13和Al14都是由多个Al原子构成的超原子,不是Al的同位素;Al13超原子中铝原子间是通过金属键结合的,不是离子键;Al14最外层电子数之和为3×14=42个价电子,比稳定结构(40个最外层电子)多2个电子,应与ⅡA族元素性质相似;Al13具有3×13=39个最外层电子,比稳定结构少1个电子,容易得到1个电子,应与卤素性质相似,具有较强的氧化性.
答案:C
1.(2009·靖江模拟)红珊瑚栖息于200-2000米的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石.在中国,珊瑚是吉祥富有的象征,一直用来制做珍贵的工艺品.红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是
( )
A.Na B.Fe C.Si D.Cu
解析:红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,而Fe(OH)3是红褐色物质,NaOH是易溶于水的,Cu(OH)2是蓝色的,硅酸盐也不是红色的,故只有B正确.
答案:B
0.005 mol 0.01 mol 0.005mol,
所以m(Mg)=0.005mol×24 g/mol=0.12 g.
则a>0.12 g.
⑤据题意知要测生成相同体积的H2所需时间从而表示出反应速率的大小.
⑥为消除压强差所引起的实验误差,应调节乙、丙中液面相平.
(1)检查该装置的气密性,可捂热锥形瓶乙,观察到广口瓶中长导管内有一段水柱上升,表明装置不漏气.
(2)若按标准状况计算,则产生H2为0.005 mol×22.4 L/mol=112 mL,若在室温下,则V(气)比 112 mL略大,因此据大而近原则,应选200 mL量筒.
(3)Vm==0.2V L/mol
(4)虽酸的浓度相同,但HCl为强酸,CH3COOH为弱酸,故c(H+)电离不同,所以反应速率不同;为防止形成原电池,实验时不能将Cu丝与酸接触.
答案:②酸式滴定管 ③0.12 ⑤反应起止时间 ⑥将量筒缓缓向下移动,使乙、丙中液面相平
(1)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(只要表述明确、合理均可)
(2)B (3) 0.2V L/mol
(4)酸的浓度相同时,c(H+)不同 防止形成的电池,干扰实验现象的观察
13.某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如下图.
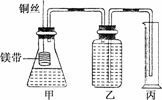
该实验的主要操作步骤如下:
①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用________量取10.00 mL 1 mol/L盐酸和醋酸溶液分别加入到两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应________,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作:
______________________________________________.
(2)本实验中应选用________(填序号)的量筒.
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=
________.
(4)简述速率不等的原因
________________________________________________________,铜丝不与酸接触的原因是__________________________________.
解析:②量取10.00 mL酸溶液应用酸式滴定管.
③因Mg - 2H+ - H2
12.对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.
若25℃时有HA
 H++A-,则K=.
H++A-,则K=.
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH  CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3  H++HCO H++HCO HCO   H++CO H++CO |
K1=4.31×10-7 K2=5.61×10-11 |
|
H2S |
H2S  H++HS- H++HS-HS-   H++S2- H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
|
H3PO4 |
H3PO4  H++H2PO H++H2PO H2PO   H++HPO H++HPO HPO   H++PO H++PO |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________.
(3)若把CH3COOH、H2CO3、HCO、H2S、HS-、H3PO4、H2PO、HPO都看作是酸,其中酸性最强的是________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是________________________________________.
解析:(1)温度升高,促进电离,所以K值增大
(2)根据题意及表中数据可知,酸性越强,对应的K值越大.
(3)利用K值进行比较,H3PO4的K值最大,HPO的K值最小.
(4)利用H3PO4的三步电离的K值进行判断.
答案:(1)增大
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强
(3)H3PO4 HPO
(4)K1∶K2∶K3≈1∶10-5∶10-10 上一级电离产生的H+对下一级电离有抑制作用
11.健康人的血液的pH保持在一定的范围内变化,这是因为血液中存在如下平衡:H2CO3
 HCO+H+,医学上称之为血液的酸碱平衡.试解答下列问题:
HCO+H+,医学上称之为血液的酸碱平衡.试解答下列问题:
(1)写出上述可逆反应达到化学平衡状态时的平衡常数的表达式:______.
(2)蚊虫、蚂蚁等昆虫叮咬人时常向人体血液内注入一种称之为蚁酸(主要成分是HCOOH)的有机酸,HCOOH同CH3COOH一样是一种有机酸,写出HCOOH在溶液中电离的方程式________.
(3)某同学郊游不慎被蜜蜂蜇伤,已知蜜蜂蜇人时分泌的液体是酸性的.该同学随身携带的物品有苹果汁、牛奶、矿泉水和香皂等,其pH分别为a、b、c、d(如下图所示,d为香皂水的pH),为了减轻蜇伤处的疼痛,应涂沫
( )
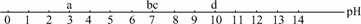
A.苹果汁 B.牛奶
C.矿泉水 D.香皂水
解析:(1)据平衡常数的定义可写出
K=.
(2)据题可知HCOOH是一种有机弱酸,所以电离方程式为HCOOH
 H++HCOO-.
H++HCOO-.
(3)因蜜蜂蜇人时分泌物是酸性的,故应涂抹碱性物质,据四种物质的溶液的pH可知应为D.
答案:(1)K=
(2)HCOOH
 H++HCOO- (3)D
H++HCOO- (3)D
10.(2009·启东联考)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:
|
酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
|
Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格判断以下说法中不正确的是
( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
解析:由电离常数的数据可知四种酸在冰醋酸中均未完全电离,酸性最强的是HClO4,最弱的是HNO3,由此可知选项C中的电离方程式应用“
 ”表示.
”表示.
答案:C
9.(2010·济宁月考)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
( )
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
解析:Cl2+H2O
 HCl+HClO,达到平衡后再通入Cl2,平衡向正方向移动,HCl是强电解质,HClO是弱电解质,所以增大;通入少量SO2后,SO2与Cl2反应,SO2+Cl2+2H2O===H2SO4+2HCl,溶液漂白性减弱;加入少量NaOH固体,可能HCl与HClO都有剩余,不一定有c(Na+)=c(Cl-)+c(ClO-).
HCl+HClO,达到平衡后再通入Cl2,平衡向正方向移动,HCl是强电解质,HClO是弱电解质,所以增大;通入少量SO2后,SO2与Cl2反应,SO2+Cl2+2H2O===H2SO4+2HCl,溶液漂白性减弱;加入少量NaOH固体,可能HCl与HClO都有剩余,不一定有c(Na+)=c(Cl-)+c(ClO-).
答案:D
8.将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和;另一份用pH=2的一元酸HB溶液中和.当恰好完全中和时,HA溶液消耗的体积和HB溶液消耗的体积分别为V1和V2,则下列叙述正确的是
( )
A.若V1>V2,则说明HA的酸性比HB的酸性弱
B.因为两种酸溶液的pH相等,故V1一定等于V2
C.若V1>V2,则说明HA的酸性比HB的酸性强
D.因为两种酸溶液的pH相等,所以HA与HB的酸性相同
解析:酸碱恰好中和时,NaOH和HA、HB的物质的量相等,则c(HA)·V1=c(HB)·V2.若V1>V2,则c(HA)<c(HB),而pH都等于2,说明HA的电离程度大于HB,故HA的酸性比HB的酸性强.
答案:C
7.(2009·济南模拟)当NaOH溶液与氨水的pH、体积都相同时,下列叙述正确的是
( )
A.两溶液的物质的量浓度相同
B.两溶液的c(H+)相同
C.用同浓度盐酸中和时,消耗酸的体积相同
D.升高温度10℃,两者pH仍相等
解析:由于氨水是弱碱,溶液中有大部分的NH3·H2O没有电离,而NaOH是强碱,当二者的pH相等时,二者的浓度应是氨水大,并且在体积相同时氨水所含的物质的量要多;当升高温度时氨水的电离平衡向右移动,则二者的pH不等;两溶液的pH相等,则c(H+)相同.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com