
题目列表(包括答案和解析)
3.按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )

①c(Ag+) ②c(NO) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④
C.①②④ D.①②⑤
解析:由图象知:装置是电镀池,所以AgNO3溶液浓度不变.
答案:D
2.下列关于铜电极的叙述正确的是
( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
解析:A项,锌比铜活泼,故铜作正极,正确;B项,电解冶炼铜时,粗铜作阳极,错误;电镀时,待镀金属作阴极,C正确;电解H2SO4制H2、O2时,阳极必为惰性电极,D错误.
答案:AC
1.(2009·镇江六校联考)用惰性电极和串联电路电解下列物质的水溶液:①NaCl, ②NaNO3, ③CuCl2, ④AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上由多到少的顺序是
( )
A.①②③④ B.④①②③
C.②①③④ D.①②④③
解析:依题意,各个电解质溶液中发生的电极反应为:
①2Cl--2e-===Cl2↑,2H++2e-===H2↑;
②4OH--4e-===2H2O+O2↑,4H++4e-===2H2↑;
③2Cl--2e-===Cl2↑,Cu2++2e-===Cu;
④4OH--4e-===2H2O+O2↑,4Ag++4e-===4Ag.
因为是串联,所以转移电子数目相同,设转移电子2 mol,则①共生成 2 mol气体,②生成1. 5 mol气体,③生成1 mol气体,④生成0.5 mol气体,A选项正确.
答案:A
22.(10分)某学生试图用电解法根据电极上析出物质的质量来验证阿伏伽德罗常数的值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图:
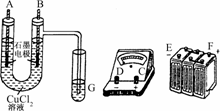
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g.
试回答:
(1)连接这些仪器的正确顺序为:(用图中标注仪器接线柱的英文字母表示,下同)E接________,C接________,________接F.
(2)写出B电极上发生反应的离子方程式________________.G试管中淀粉KI溶液变化的现象为__________________,相应的离子方程式是__________________.
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________.(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电荷量为1.6×10-19 C.试列出阿伏伽德罗常数的计算表达式:NA=________.
解析:(1)B电极上应产生Cl2:2Cl--2e-===Cl2↑,B极上流出电子,电子进入直流电源的正极,即F极,由此可得仪器连接顺序及电流方向.
(2)B中产生Cl2,Cl2进入G中与KI反应,有I2生成,I2使淀粉变蓝色.
(3)镀在A电极上的Cu是没必要刮下的,也无法刮干净,故②⑤两步须排除在外.
(4)因为析出Cu的物质的量= mol,电子转移物质的量为×2 mol,即×2×NA个电子,由于电子的电荷量为1.6×10-19C,所以×2×NA×1.6×10-19=It,
则 NA=×mol-1
答案:(1)D A B
(2)2Cl--2e-===Cl2↑ 溶液变蓝
Cl2+2I-===2Cl-+I2
(3)①③④⑥
(4)×mol-1
20.(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
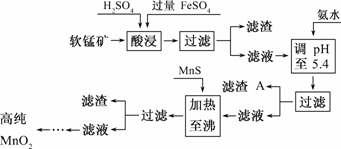
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%) 等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
pH |
|
Al(OH)3 |
5.2 |
|
Fe(OH)3 |
3.2 |
|
Fe(OH)2 |
9.7 |
|
Mn(OH)2 |
10.4 |
|
Cu(OH)2 |
6.7 |
|
Zn(OH)2 |
8.0 |
|
CuS |
≥-0.42 |
|
ZnS |
≥2.5 |
|
MnS |
≥7 |
|
FeS |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
解析:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写其反应方程式2FeSO4+MnO2+2H2SO4===MnSO4+Fe2(SO4)3+2H2O.
(2)根据反应后滤液(Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+)加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH)3和Al(OH)3.
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子.其电极反应式应为 MnO2+H2O+e-===MnOOH+OH-.
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2.
答案:(1)MnO2+2FeSO4+2H2SO4===MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3
(3)Cu2+、Zn2+
(4)MnO2+H2O+e-===MnOOH+OH-
(5)Zn、MnO2
19.(10分)在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答:

(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.
解析:(1)据题目现象可判断出阳极产物为I2,故电极反应为2I--2e-===I2;
(2)阴极产生无色气泡,说明H+放电,反应为2H++2e-===H2↑;
(3)结合(1)(2)分析可知上层液体为活泼金属碘化物,可为KI或NaI;
(4)下层液体难溶于水且比水的密度大的有机溶剂通常为CCl4;
(5)因I2易溶于有机溶剂,故搅拌后I2溶于CCl4中,所以下层液体呈紫红色;
(6)检验K+(或Na+),可通过焰色反应来证明.
答案:(1)2I--2e-===I2
(2)2H++2e-===H2↑
(3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其他合理答案同样给分.例如,若③中答NaI水溶液,这里答火焰呈黄色)
18.(7分)甲、乙两池的电极材料都是铁棒与碳棒(如下图).请回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的________棒;乙池中的________棒.
②在乙池中阴极的电极反应式是________________.
(2)若两池中均盛放饱和NaCl溶液,反应一段时间后:
①写出乙池中发生的总反应的离子方程式____________________.
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________.
③若乙池转移0.02 mol电子后停止实验,池中溶液的体积是200 mL,则溶液混匀后的pH=________.
解析:甲池为原电池,乙池为电解池,且甲池中Fe为负极,乙中Fe为阴极,C为阳极.
(1)均盛放CuSO4溶液时,甲池中发生的反应为Fe+Cu2+===Fe2++Cu,乙池中发生的反应为2Cu2++2H2O2Cu+4H++O2↑.
(2) ①均盛放NaCl溶液时,甲池中发生吸氧腐蚀,乙池中发生的反应为2Cl-+2H2OCl2↑+H2↑+2OH-,②Cl2再氧化I2,结合物质的量之比为5∶1,利用电子守恒即得出方程式为5Cl2+I2+6H2O===10HCl+2HIO3.③2Cl-+2H2OCl2↑+H2↑+2OH-,因此每生成2 mol OH-,即转移2 mol e-,所以n(OH-)=n(e-)=0.02 mol, c(OH-)==0.1 mol/L,
所以pH=13.
答案:(1)①碳(C) 铁(Fe)
②Cu2++2e-===Cu
(2)①2Cl-+2H2O2OH-+H2↑+Cl2↑
②5Cl2+I2+6H2O===10HCl+2HIO3
③13
17.(10分)工业上处理含Cr2O的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准.试回答:
(1)电解时的电极反应:阳极________________,阴极__________________________.
(2)Cr2O转变成Cr3+的离子反应方程式:_____________________.
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?
______________________________________.
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由______________________.
解析:(1)阳极Fe为活性电极,反应为Fe-2e-===Fe2+,在阴极是H+放电生成H2,反应为2H++2e-===H2↑.
(2)阳极生成的Fe2+具有较强的还原性,易被酸性条件下的Cr2O氧化,反应为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O.
(3)因在阴极H+放电,同时Cr2O氧化Fe2+时都要消耗H+ ,使溶液的pH上升,促使Fe3+、Cr3+水解并最终完全转化为Cr(OH)3、Fe(OH)3沉淀.
(4)若用Cu代替Fe电极,则Cu-2e-===Cu2+,但Cu2+无还原性,不能将Cr2O还原.
答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O
(3)在阴极反应及Cr2O与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
(4)不能 因为阳极产生的Cu2+不能使Cr2O还原到低价
16.下列关于实验现象的描述不正确的是
( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作阳极,铁片作阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
解析:铜、铁是两种活泼性不同的金属,稀硫酸是电解质溶液,三者共同形成原电池,铁片上发生氧化反应:Fe-2e-===Fe2+,铜片上发生还原反应:2H++2e-===H2↑,故A选项正确.
B选项中的条件相当于在铁片上镀锌即电镀池,锌片上发生的反应为:Zn-2e-===Zn2+,铁片上发生的反应为:Zn2++2e-===Zn,理论上ZnCl2溶液的浓度不变,故B选项也正确.
Cu+2FeCl3===2FeCl2+CuCl2,故C选项错误.
Zn+2HCl===ZnCl2+H2↑,向其中加入几滴氯化铜溶液后,发生反应Zn+Cu2+===Zn2++Cu,则铜和锌及电解质溶液形成了原电池,发生原电池反应,加快了氢气的放出速率,故D选项也正确.
答案:C
第Ⅱ卷 (非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com