
题目列表(包括答案和解析)
9.(2009·茂名高考模拟)可以将反应Zn+Br2===ZnBr2设计成可充电电池,下列4个电极反应:
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
( )
A.②和③ B.②和①
C.③和① D.④和①
解析:放电原理是原电池原理,较活泼的金属作为原电池的负极,故放电时负极反应为③.充电原理是电解原理,在可充电电池中,阳极所发生的反应为补充原来正极的反应,即用来补充消耗掉的Br2,故反应为②,即选项A正确.
答案:A
8.下列说法正确的是
( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质没有储存在电池内部
解析:碱性锌锰电池属于干电池类,故应为一次电池.铅蓄电池是可充电电池,即它放电后可以再充电使电池内部的活性物质获得再生,又叫二次电池.燃料电池与普通电池的区别就在于燃料电池的活性物质没有储存在电池内部,而是由外部进行不断的供应.所以本题正确的选项是C、D两项.
答案:CD
7.镍镉(Ni-Cd)可充电电池在现代生活中被广泛应用,它充电、放电时按下式进行:Cd(OH)2+2Ni(OH)2充电放电Cd+2NiOOH+2H2O,由此可知,该电池放电时的负极材料是
( )
A.Cd(OH)2 B.Ni(OH)2
C.Cd D.NiOOH
解析:放电时为原电池,要注意上式向左进行为放电.负极发生氧化反应,失电子,化合价升高,故负极材料为Cd,C项正确.
答案:C
6.(2009·福建理综高考)控制适合的条件,将反应2Fe3++2I-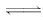
 2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
2Fe2++I2设计成如下所示的原电池.下列判断不正确的是
( )
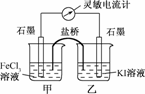
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
解析:由反应2Fe3++2I-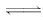
 2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;电流计读数为零,说明单位时间内由甲流向乙的电子数与由乙流向甲的电子数相等,生成Fe3+的物质的量与消耗的Fe3+相等,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极;故选D.
2Fe2++I2可知,反应开始时甲中Fe3+发生还原反应,乙中I-发生氧化反应;电流计读数为零,说明单位时间内由甲流向乙的电子数与由乙流向甲的电子数相等,生成Fe3+的物质的量与消耗的Fe3+相等,则反应达到了平衡状态,此时在甲中溶入FeCl2固体,则平衡向逆反应方向移动,乙中I2发生还原反应,则乙中石墨电极为正极;故选D.
答案:D
5.人们利用原电池原理,制作了多种电池,如电子计算机所用钮扣电池就是其中一种.它的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e-===ZnO+H2O;Ag2O+H2O+2e-===2Ag+2OH-.下列判断正确的是
( )
A.锌为正极,Ag2O为负极
B.锌为负极,Ag2O为正极
C.原电池工作时,负极区溶液pH减小
D.原电池工作时,负极区溶液pH增大
解析:原电池中失去电子的电极为负极,所以锌为负极,Ag2O为正极,B是正确答案.因为Zn+2OH--2e-===ZnO+H2O,负极区域溶液c(OH-)不断减少,故pH减小,所以C也正确.
答案:BC
32.5 g 1 mol 1 mol 0.5 mol
故A正确.
答案:A
4.在铜-锌-稀硫酸构成的原电池中,当导线中有1 mol电子通过时,理论上的两极变化是
( )
①锌片溶解了32.5 g ②锌片增重了32.5 g ③铜片上析出1 g H2 ④铜片上析出1 mol H2
A.①③ B.①④
C.②③ D.②④
解析:铜-锌-稀硫酸构成的原电池反应为:
负极Zn- 2e-===Zn2+ 正极2H++2e-=== H2↑
65 g 2 mol 2 mol 1 mol
3.(2009·山东济宁模拟)一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2===2CO2.则下列说法中正确的是
( )
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO
C.负极发生的电极反应是:CO+CO-2e-===2CO2
D.正极发生氧化反应
解析:据题意知通入CO的一极为电源的负极,CO失去电子转变为CO2,负极发生氧化反应,故A、B、D错误,C正确.
答案:C
2.在用Zn片、Cu片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是
( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量浓度减小
D.电解质溶液的pH保持不变
解析:活泼金属锌为负极,电流方向由正极到负极,与电子流动方向相反.随着H+消耗,溶液的pH逐渐增大.
答案:C
1.“嫦娥”一号(如右图)的供配电由同位素电池(利用放射性同位素在衰变时释放巨大能量的原理制作)、太阳能电池、镍氢蓄电池组提供.当月球探测器穿过月食有效阴影区时,由于在月食阴影区没有太阳照射,会引起太阳能电池无法工作,动力由携带的蓄电池提供.下列说法不正确的是
( )

A.太阳能电池可以充当镍氢蓄电池的电源
B.蓄电池放电的电子流向为正极→负极
C.若仅从保护环境的角度考虑,要尽量使用太阳能电池和镍氢蓄电池
D.镍氢蓄电池放电时的正极要与外加电源的正极相连
解析:镍氢蓄电池为可充电电池,充电时可用太阳能电池作电源,A正确;其放电时为原电池装置,电子应从负极流出流向正极,B错误;太阳能电池无污染,而镍氢电池为可充电电池,降低了污染,C正确;镍氢电池放电时的正极要与外加电源的正极相连,D正确.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com