
题目列表(包括答案和解析)
17.(6分)请简要叙述下图所示的实验装置、方法、操作中存在的错误.

(1)________________________________;
(2)________________________________;
(3)________________________________;
(4)________________________________;
(5)________________________________;
(6)________________________________.
解析:(1)向试管中滴加液体时,试管要竖直,滴管要垂直悬空.
(2)给试管中液体加热时,液体体积不能超过试管容积的,加热时,应用酒精灯的外焰加热.
(3)蒸馏时,温度计水银球应在蒸馏烧瓶的支管口处.
(4)过滤时玻璃棒下端放在三层滤纸处.
(5)NO不能用排空气法收集,只能用排水法.
(6)铁丝在氧气中燃烧时,应在瓶底铺层细沙或瓶中放少量水.
答案:(1)试管没竖直;滴管口接触管壁
(2)试管底部放在酒精灯焰芯上;试管内液体体积不能超过试管容积的1/3
(3)温度计的水银球插在乙醇溶液中
(4)玻璃棒没有接触滤纸三层的一边
(5)不能用排空气法收集NO
(6)瓶底没有铺一层细沙或瓶里没有加少量水
16. (2009·广州二中等六校联考)下列叙述正确的是
( )

A.为提醒人们在使用浓H2SO4时要注意安全,贮存浓H2SO4的容器上贴有右图标识
B.实验室可通过蒸馏的方法除去自来水中含有的Cl-等杂质制蒸馏水
C.做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净后,在酒精灯外焰上灼烧至没有颜色时,再蘸取待检溶液进行实验
D.由于碱金属单质化学性质活泼,实验室中的各种碱金属单质均保存在煤油中
解析:浓H2SO4具有强腐蚀性,而非剧毒品,A错误;通过蒸馏可以得到纯净的蒸馏水,B正确;做焰色反应实验时,铂丝应用稀HCl清洗,不能用稀H2SO4,C错误;碱金属中锂比煤油的密度小,应用石蜡密封,D错误.
答案:B
第Ⅱ卷 (非选择题,共52分)
15.用CuSO4·5H2O配制0.1 mol/L CuSO4水溶液,下面所列的方法正确的是
( )
A.取25 g CuSO4·5H2O溶于1 L水中
B.将CuSO4·5H2O干燥去掉结晶水,取16 g溶于水制成1 L溶液
C.将25 g CuSO4·5H2O溶于水制成1 L溶液
D.取12.5 g CuSO4·5H2O溶于500 mL水中
解析:CuSO4·5H2O的摩尔质量是250 g/mol,25g CuSO4·5H2O的物质的量是0.1 mol.将其溶解到水中,配成1 L溶液,即得0.1 mol/L的CuSO4溶液.将25 g CuSO4·5H2O溶在1 L水中或将12.5 g CuSO4·5H2O溶在500 mL水中,溶液的体积都不是1 L或500 mL,所得溶液浓度不是0.1 mol/L.将CuSO4·5H2O干燥去掉结晶水后得CuSO4,但由于CuSO4·5H2O干燥去掉结晶水时不知何时结晶水完全去掉,无法保证所取固体为纯CuSO4,此法不正确,且此法不符合最简单原则.
答案:C
14.下列叙述中正确的是
( )
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤在同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比.
A.①②③ B.②⑤⑥
C.②③⑥ D.④⑤⑥
解析:标准状况下H2O不是气体,而HCl为气体,所以虽然二者等体积,但物质的量不相同,①错误;同样在④中所指的物质不一定是气体,所以④错误;标准状况下,1 g H2和14 g N2的物质的量均为0.5 mol,故体积相同,②正确;③中28 g CO的物质的量是1 mol,但条件不确定,所以不一定是22.4 L,③错误;在同温同体积时,气体的压强与物质的量成正比,所以物质的量越大,则压强越大,⑤正确;同温同压下,气体的密度与其相对分子质量成正比,⑥正确,故选B.
答案:B
13.(2009·苏州模拟)实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
( )
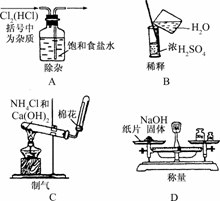
解析:A中气体应长进短出;B中有两处错误,一是不能在量筒中稀释浓硫酸,二是不能将水倒入浓H2SO4中;D中称量NaOH固体不能放在纸片上,应放在烧杯中称量;C中所用原料、方法、装置均正确.
答案:C
12.(2009·石家庄质检)工业上以CaO和HNO3 为原料制备Ca(NO3)2·4H2O晶体.为了确保制备过程中既不补充水,也无多余水分,所用硝酸溶液溶质的质量分数应为
( )
A.30% B.63%
C.70% D.无法确定
解析:反应方程式为:
CaO+2HNO3+3H2O===Ca(NO3)2·4H2O,
硝酸质量分数为×100%=70%.
答案:C
11.在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是
( )
A.NaOH B.NH3·H2O
C.AgNO3 D.BaCl2
解析:加入NaOH溶液,有刺激性气味产生的是(NH4)2SO4,无明显现象的是KCl,产生白色沉淀的是MgCl2,先生成白色沉淀后来沉淀又溶解消失的是Al2(SO4)3,产生红褐色沉淀的是Fe2(SO4)3;加入NH3·H2O、(NH4)2SO4和KCl无法鉴别开,MgCl2与Al2(SO4)3均会产生白色沉淀,也鉴别不开;五种盐溶液中,有2种氯化物,3种硫酸盐,因此利用Ag+、Ba2+无法鉴别,故只有A正确.
答案:A
10.如下图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
( )

①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
解析:在光照条件下,CH4与Cl2发生化学反应,产物中有HCl生成,因HCl易溶于水,使集气瓶中压强减小,水会倒吸其中,②正确;当滴入水时,反应4NO2+O2+2H2O===4HNO3也会使集气瓶内压强减小,发生水倒吸入集气瓶中的现象,③正确;①中CO、O2均不溶于水,①错误;④中N2、H2也不溶于水,光照时也不发生反应,④错误,故D正确.
答案:D
9.(2010·广东、韶关模块考试)为了除去粗盐中的Ca2+、Mg2+、SO及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的操作顺序是
( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.④②⑤①③ D.⑤②④①③
解析:OH-与Mg2+反应产生难溶的Mg(OH)2沉淀,Ba2+与SO生成BaSO4沉淀,这两个过程互不影响,可以颠倒;加入CO可以除去Ca2+和过量的Ba2+;过滤,防止加酸使Mg(OH)2和CaCO3溶解;最后加酸中和过量的碱及除去CO,故只有D正确.
答案:D
8.下列叙述正确的是
( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH所含质子数相等
解析:1个N2分子含有2个氮原子,1个O3分子有3个氧原子,故相同条件下,等体积的N2和O3的混合气体与N2所含的原子数不相等,A错误;1个甲基含9个电子,1个羟基含9个电子,因此,等物质的量的甲基与羟基所含的电子数相等,B正确;常温常压下22.4 L O2不是1 mol,C错误;16 g CH4含质子数为×10×NA=10NA,18 g NH所含质子数为×11×NA=11NA,D错误.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com