
题目列表(包括答案和解析)
19.(8分)A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合.(要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度.)
(1)写出化学式:A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为____________;
(3)写出0.1 mol/L的A2溶液中离子浓度大小排序______________________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是________________________________;
(5)常温下,若B1、B2两溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________.
解析:根据给出的元素:H、N、O、Na,其中由三种元素组成的强电解质有强碱(NaOH)、强酸(HNO3)、盐:NaNO3、NaNO2、NH4NO3、NH4NO2等,A显碱性,只可能是NaOH和NaNO2,B显酸性,可能是HNO3和NH4NO3.强酸、强碱都抑制水的电离,而易水解的盐则促进水的电离.故四种物质分别为NaOH、NaNO2、HNO3和NH4NO3.
(2)相同物质的量浓度的NaOH和HNO3对水的抑制程度相同,故两溶液中水电离出的H+浓度之比为1∶1.
(3)NaNO2为强碱弱酸盐,故各离子浓度为c(Na+)>c(NO)>c(OH-)>c(H+).
(4)因HNO3电离出的H+抑制了H2O的电离,而NH4NO3中NH的水解促进了水的电离.
(5)在HNO3溶液中c(H+)水==1×10-9 mol/L,在NH4NO3溶液中,由水电离出的c(H+)=1×10-5 mol/L,故二者之比为1×10-9∶1×10-5=1×10-4∶1
答案:(1)NaOH NaNO2 HNO3 NH4NO3 (2)1∶1
(3)c(Na+)>c(NO)>c(OH-)>c(H+)
(4)硝酸电离出的H+抑制了水的电离,NH结合水电离出的OH-促进了水的电离
(5)1×10-4∶1或(1∶104)
18.(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸.
②用0.1000 mol/L的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL.
③用测定的Ba(OH)2溶液吸收定量空气中的CO2,取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀.
④过滤上述所得浊液.
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL.请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?________;
A.托盘天平 B.容量瓶
C.酸式滴定管 D.量筒
E.烧杯 F.胶头滴管
G.玻璃棒
(2)滴定操作中,左手________,右手________,眼睛________;
(3)Ba(OH)2溶液的物质的量浓度是________;
(4)过滤所得浊液的目的是________;
(5)此空气样品中含CO2的体积分数为________;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”).
解析:(1)配制一定物质的量浓度的盐酸时,需要仪器有容量瓶、量筒、烧杯、胶头滴管及玻璃棒.
(2)滴定操作时,左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化.
(3)Ba(OH)2+2HCl===BaCl2+2H2O,则c[Ba(OH)2]×10.00 mL=×0.1 mol/L×19.60 mL解得c[Ba(OH)2]=0.098 mol/L.
(4)为防止BaCO3与HCl反应,应分离出BaCO3.
(5)Ba(OH)2+CO2===BaCO3↓+H2O,只要求出余下的Ba(OH)2,就可以计算与CO2反应的Ba(OH)2,CO2的量也就计算出来了.过程如下:20 mL滤液中Ba(OH)2的物质的量为34.80×10-3×0.01× mol=0.174×10-3 mol, 那么100 mL滤液中有Ba(OH)2:0.174×10-3×5 mol=0.870×10-3 mol,原有Ba(OH)2∶ 10×10-3 L×0.098 mol/L=0.980×10-3 mol,与CO2反应的Ba(OH)2有(0.980-0.870)×10-3 mol=0.110×10-3 mol,则n(CO2)=0.110×10-3 mol,则φ(CO2)×100%=0.025%.
(6)偏大,因为第二次滴定消耗标准盐酸偏少,使计算出的剩余Ba(OH)2偏少,那么与CO2反应的Ba(OH)2就偏多.
答案:(1)B、D、E、F、G
(2)控制活塞 摇动锥形瓶 注视锥形瓶内溶液颜色的变化
(3)0.0980 mol/L
(4)分离出BaCO3,防止HCl与BaCO3反应
(5)0.025%
(6)偏大
17.(8分)某二元酸(H2A)在水中的电离方程式是:
H2A===H++HA- HA-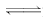
 H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”,“中性”或“碱性”),理由是________.(用离子方程式表示)
(2)已知0.1 mol/L NaHA溶液的pH=2,则0.1 mol/L H2A溶液中氢离子的物质的量浓度应________0.11 mol/L(填“<”, “>”或“=”),理由是____________________________________________.
(3)H2A溶液和Na2A溶液能否发生反应?________.能反应的写出离子方程式________________.
解析:(1)HA-部分电离,相当于是弱酸,则其盐Na2A由于A2-水解,水溶液应呈碱性.
(2)0.1 mol/L NaHA溶液pH=2,则c(H+)=0.01 mol/L,0.1 mol/L H2A溶液中H2A第一步电离出c(H+)=0.1 mol/L,c(HA-)=0.1 mol/L,因为第一步电离出的H+抑制了HA-的进一步电离,故0.1 mol/L H2A溶液中氢离子浓度小于0.11 mol/L.
(3)H2A与Na2A可反应生成NaHA.
答案:(1)碱性 A2-+H2O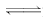
 HA-+OH-
HA-+OH-
(2)< 因H2A第一步电离产生的H+抑制了HA-的电离
(3)能 H++A2-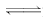
 HA-
HA-
16.为了配制NH的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入①适量NH4NO3;②适量NaCl;③适量氨水;④适量NaOH
( )
A.①② B.②③
C.①③ D.②④
解析:在NH4Cl溶液中存在NH+H2O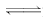
 NH3·H2O+H+,使c(NH)∶c(Cl)<1∶1,要使c(NH)∶c(Cl-)=1∶1,其方法一是增大NH的浓度(如①),二是使上述平衡向左移动(如③),故选C.
NH3·H2O+H+,使c(NH)∶c(Cl)<1∶1,要使c(NH)∶c(Cl-)=1∶1,其方法一是增大NH的浓度(如①),二是使上述平衡向左移动(如③),故选C.
答案:C
第Ⅱ卷 (非选择题,共52分)
15.把1 mL 0.1 mol/L的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
( )
A.1×10-4 mol/L B.1×10-8 mol/L
C.1×10-11 mol/L D.1×10-10 mol/L
解析:稀释后c(H+)==1×10-4 mol/L,
所以c(H+)水=c(OH-)==1×10-10 (mol/L),故选D.
答案:D
14.醋酸的下列性质中,可以证明它是弱电解质的是
( )
A.醋酸溶液可与纯碱溶液反应产生CO2
B.相同pH的醋酸溶液和盐酸分别跟同样颗粒大小的锌反应时,产生H2的起始速率相等
C.10 mL 1 mol/L醋酸溶液恰好与10 mL 1 mol/L NaOH溶液完全反应
D.在相同条件下,醋酸溶液的导电性比盐酸溶液的弱
解析:A项说明CH3COOH的酸性强于H2CO3,无法证明其为弱电解质,错误;B项因pH相同,c(H+)相同,故开始生成H2的速率相等,B错误;中和碱的能力与酸的强弱无关,C错误;证明CH3COOH是弱酸应从它不完全电离来说明.相同条件下,CH3COOH溶液的导电性比盐酸的导电性弱,说明其溶液中离子浓度小,即CH3COOH电离程度小,D正确.
答案:D
13.(2009·江苏南通高三调研)下列有关实验的说法正确的是
( )
A.将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体
B.测量溶液的导电性可区分出试剂盐酸和醋酸,导电能力强的是盐酸
C.做完银镜反应后的试管可用热的稀硝酸清洗,回收后的硝酸银溶液可再利用
D.除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化
解析:A项,AlCl3溶液在加热蒸发时,Al3+会水解,最终得到Al2O3固体,A错.B项,溶液导电性强弱与溶液中离子浓度大小有关,而与溶质是强、弱电解质无关,B错.可在相同条件下测量等物质的量浓度的盐酸和醋酸溶液的导电性,则导电能力强的是盐酸.C项,清洗“银镜”应用稀硝酸,生成的AgNO3需回收利用,C对.D项,加入足量NaOH,则又混入了新的杂质,D错.
答案:C
12.下列溶液中各粒子的浓度关系不正确的是
( )
A.0.1 mol/L HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1L 0.1 mol/L CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO)>c(NH)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO)+c(CO)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
解析:A项中,由溶液中电荷守恒可得;B项中,溶液中NH发生水解使溶液呈酸性;C项中,由电荷守恒得:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-),故有c(Na+)+c(H+)+c(H2CO3)>c(HCO-3)>c(CO)+c(OH-);D项中,由于X-的水解和HX的电离程度不确定,所以就无法确定溶液的酸碱性.
答案:CD
11.下列有关实验的叙述正确的是
( )
A.浓硝酸可保存在带橡皮塞的棕色细口瓶中
B.用pH试纸测定溶液pH时,pH试纸不应事先润湿
C.配制一定物质的量浓度的溶液时,选用的容量瓶规格由需配制的溶液体积决定
D.中和滴定时,为了使滴定终点溶液颜色变化明显,可多滴几滴指示剂
解析:A项,浓HNO3有强氧化性,保存时不能用橡皮塞;B项,pH试纸测的是待测溶液中c(H+),若先润湿可能造成误差;C项,多大规格的容量瓶只能配制相应体积的溶液;D项,指示剂本身也是有机弱酸或弱碱,多滴会增大误差.
答案:BC
10.在常温时的下列溶液中,BaSO4的溶解度最大的是
( )
A.40 mL 1 mol/L的BaCl2溶液
B.30 mL 2 mol/L的Ba(OH)2溶液
C.10 mL纯水
D.50 mL 0.1 mol/L的H2SO4溶液
解析:BaSO4在水中存在如下平衡:BaSO4(s)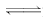
 Ba2+(aq)+SO(aq).A项BaCl2中的Ba2+促使平衡左移,溶解度减小;B项Ba(OH)2中的Ba2+同样使平衡左移,溶解度减小;C项纯水中BaSO4的溶解度不受影响;D项中,SO使平衡左移,溶解度减小.
Ba2+(aq)+SO(aq).A项BaCl2中的Ba2+促使平衡左移,溶解度减小;B项Ba(OH)2中的Ba2+同样使平衡左移,溶解度减小;C项纯水中BaSO4的溶解度不受影响;D项中,SO使平衡左移,溶解度减小.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com