
题目列表(包括答案和解析)
8.(2009·江苏模拟)t℃时,水的离子积常数为KW,该温度下将a mol/L一元酸HA与b mol/L一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
( )
A.混合液的pH=7
B.混合液中,c(H+)=
C.a=b
D.混合液中,c(B+)=c(A-)+c(OH-)
解析:溶液显中性,若t≠25℃, pH≠7,A项错误;c(H+)=c(OH-), c(H+)=,B项正确;由于一元酸和一元碱等体积混合二者不一定恰好反应,所以a=b 不一定成立,C项错误;在混合液中由于电荷守恒,c(B+)+c(H+)=c(A-)+c(OH-),D项错误.
答案:B
7.(2009·日照高三模拟考试)下列各选项中所述的两个量,前者一定大于后者的是
( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.纯水在25℃和80℃时的pH
C.在NH3+NO―→N2+H2O反应中,被氧化和被还原的N原子个数
D.pH相同的等体积的盐酸和醋酸分别与足量锌粒反应产生的气体体积
解析:选项A,溶液越稀,CH3COOH的电离程度越大,故后者溶液中H+数大于前者.选项B,H2O是弱电解质,温度越高,H2O电离产生的H+浓度越大,pH越小.选项C,NH3被氧化,NO被还原,根据得失电子守恒可知被氧化的N原子数是被还原的N原子数的2/3倍.选项D,pH相同且体积相等的盐酸和CH3COOH,CH3COOH的浓度大于盐酸的浓度,故与足量Zn反应时醋酸放出的H2较多.
答案:B
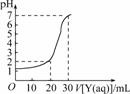
6.如图所示为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的
( )
|
|
A |
B |
C |
D |
|
X(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
解析:由图知,30 mL NaOH溶液恰好中和10 mL盐酸,即3Y=X,表中A、D属此种情况,但A组中X=0.12 mol/L,c(H+)=0.12 mol/L, pH<1,不符合图象,D组中X=0.09 mol/L, pH>1,加入20 mL NaOH后溶液的
c(H+)=
=1×10-2 mol/L, pH=-lg(1×10-2)=2,正好符合题意.
答案:D
5.常温下,某溶液中由水电离的c(H+)=1×10-13 mol/L,该溶液可能是
( )
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④
解析:因水电离出的c(H+)=1×10-13 mol/L<10-7 mol/L,故H2O的电离受到抑制,该溶液可为酸溶液,也可为碱溶液,故选A.
答案:A
4.下列可用于测定溶液pH且精确度最高的是
( )
A.酸碱指示剂 B.pH计
C.精密pH试纸 D.广泛pH试纸
解析:A项酸碱指示剂只能测定溶液的酸碱性;C项pH试纸只能比较粗略的测出溶液的pH;D项广泛pH试纸只能测出pH的整数值.
答案:B
3.(2009·福州质检)下列溶液一定呈中性的是
( )
A.将pH=5的盐酸稀释100倍所得到的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.c(H+)=c(OH-)=1×10-6 mol/L的溶液
D.非电解质溶于水得到的溶液
解析:A项错误;B项酸、碱元数不定,故错误;C项正确;D项CO2的水溶液呈酸性,NH3的水溶液呈碱性,故错误.
答案:C
2.将纯水加热至较高温度,下列叙述正确的是
( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
解析:H2O的电离为吸热反应,将纯水加热至较高温度,电离平衡向正方向移动,c(H+)、c(OH-)增大,则水的离子积KW=c(H+)×c(OH-)增大,pH=-lgc(H+)减小,而c(H+)=c(OH-),溶液呈中性.
答案:D
1.2008年5月8日,奥运圣火成功登顶珠峰,为此某班举行了庆祝晚会.晚会上赵东同学将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“奥运成功!中国加油!”的红色大字立刻显现于纸上.他所用的显色反应是下列哪一组?
( )
A.酚酞--盐酸溶液
B.酚酞--氢氧化钠溶液
C.石蕊--氢氧化钠溶液
D.碘水--淀粉溶液
解析:A项不变色,B项变红,C项变蓝,D项变蓝,故选B.
答案:B
13.已知25℃时,A酸的溶液pH=a,B碱的溶液pH=b.
(1)若A为强酸,B为强碱,且a+b=14,两者等体积混合后,溶液的pH=________,此时若溶液中阳离子浓度大于阴离子浓度,其可能原因是______________________________;强酸强碱按体积比为1∶10混合后溶液显中性,则a+b=________.
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者体积混合溶液显酸性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为__________________________;混合后的溶液中,下列粒子浓度大小关系一定正确的是________(填序号).
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
解析:(1)A为强酸(HnA),B为强碱[B(OH)m],且a+b=14,二者等体积混合时,酸碱恰好完全反应,溶液呈中性.根据电荷守恒有nc(An-1)=mc(Bm+),若c(Bm+)>c(An-),则n>m,推知HnA可能是二元强酸,B(OH)m可能是一元强碱;pH=a的强酸的c(H+)=10-a,pH=b的强碱的c(OH-)=10-14+b,强酸和强碱按体积比1∶10混合后溶液呈中性,则有:1×10-a=10×10-14+b=10-13+b,解得a+b=13.
(2)混合后溶液呈酸性,说明HR过量,HR为弱酸,R-发生水解:R-+H2O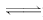
 HR+OH-.反应后所得溶液为HR和MR的混合液,根据电荷守恒有:c(H+)+c(M+)=c(R-)+c(OH-).因溶液呈酸性,所以HR的电离能力大于R-的水解能力,故有c(R-)>c(M+)>c(H+)>c(OH-).
HR+OH-.反应后所得溶液为HR和MR的混合液,根据电荷守恒有:c(H+)+c(M+)=c(R-)+c(OH-).因溶液呈酸性,所以HR的电离能力大于R-的水解能力,故有c(R-)>c(M+)>c(H+)>c(OH-).
答案:(1)7 酸为二元强酸,碱为一元强碱 13
(2)R-+H2OHR+OH- ③⑤
12.现有常温下的0.1 mol/L纯碱溶液.
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):______________________.为证明你的上述观点,请设计一个简单的实验,简述实验过程.
__________________________________________.
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO不超过其总量的10%.请你设计实验证明该同学的观点是否正确.______________________________________________.
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是________.
A.c(Na+)=2c(CO)
B.c(CO)>c(OH-)>c(HCO)>c(H2CO3)
C.c(CO)+c(HCO)=0.1 mol/L
D.c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
(4)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式________________.
解析:(1)Na2CO3属强碱弱酸盐,CO水解而显碱性,为证明这一点,可向Na2CO3溶液中滴入几滴酚酞,溶液显红色,然后加入过量CaCl2,若红色消失即证明是因CO所致.
(2)为了证明这点,可用pH试纸测常温下0.1 mol/L的纯碱溶液的pH,若pH<12,则c(H+)>10-12 mol/L,即c(OH-)<10-2 mol/L,所以可得出水解的CO数目不会超过其总量的10%.
(3)因CO水解,故c(Na+)>2c(CO),A错误;据CO的两步水解方程式便知c(CO)>c(OH-)>c(HCO)>c(H2CO3),B正确;C项由物料守恒知c(CO)+c(HCO)+c(H2CO3)=0.1 mol/L;D项属质子守恒.
(4)类比化学平衡常数的定义写出
Kh=.
答案:(1)CO+H2O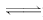
 HCO+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
HCO+OH- 向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点
(2)用pH试纸(或pH计)测常温下0.1 mol/L纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确
(3)BD (4)Kh=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com