
题目列表(包括答案和解析)
5.下表中物质的分类组合正确的是
( )
|
|
A |
B |
C |
D |
|
强电解质 |
Al2(SO4)3 |
BaSO4 |
HClO |
KCl |
|
弱电解质 |
H3PO4 |
H2O |
CaCO3 |
Al(OH)3 |
|
非电解质 |
CO2 |
NH3·H2O |
NH3 |
HI |
解析:B项中的NH3·H2O属于弱电解质;C项中的HClO属于弱电解质,CaCO3属于强电解质;D项中的HI属于强电解质.
答案:A
4.已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A.加少量烧碱溶液 B.升高温度
C.加少量冰醋酸 D.加水
解析:本题中提供的四种措施都会使醋酸的电离平衡正向移动,但A、C项会使c(H+)/c(CH3COOH)值减小.
答案:BD
3.(2009·安徽峰埠质检)把1 L 0.1 mol/L醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是
( )
A.c(CH3COOH)变为原来的1/10
B.c(H+)变为原来的
C.c(CH3COO-)/c(CH3COOH)的比值增大
D.溶液的导电性增强
解析:CH3COOH CH3COO-+H+,当加水稀释时,CH3COOH、CH3COO-、H+浓度均减小,但电离为可逆的,故A项、B项、D项错误,C项正确.
CH3COO-+H+,当加水稀释时,CH3COOH、CH3COO-、H+浓度均减小,但电离为可逆的,故A项、B项、D项错误,C项正确.
答案:C
2.下列叙述中正确的是
( )
A.电解质和非电解质都是化合物
B.非电解质比电解质难溶于水
C.强电解质在熔融时都能导电
D.强电解质导电能力比弱电解质强
解析:电解质和非电解质均是化合物,A正确;蔗糖属非电解质,但易溶于水,BaSO4属强电解质,却难溶于水,B错误;H2SO4属强电解质,但熔融时不导电,C错误;溶液的导电能力与电解质的相对强弱无必然关系,而取决于离子所带电荷的浓度,D错误.
答案:A
1.下列事实可以证明氨水是弱碱的有
( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1 mol/L氨水可以使酚酞试液变红
D.0.1 mol/L氯化铵溶液的pH约为5
解析:证明氨水呈弱碱性的基本原理只有两个:①证明氨水不能完全电离,溶液中存在电离平衡;②证明氨水与强酸反应后生成的盐溶液呈酸性.D中NH4Cl的水溶液呈酸性,符合上述原理②,其他选项均不合理.
答案:D
13.在25℃时,有pH=a的盐酸与pH=b的NaOH溶液,取Va L该盐酸同该NaOH溶液恰好反应,需NaOH溶液Vb L,问:
(1)若a+b=14时,则Va/Vb=________(填数值);
(2)若a+b=13时,则Va/Vb=________(填数值);
(3)若a+b>14时,则Va/Vb=________(填数值);Va________Vb(填“>”、“<”或“=”).
解析:pH=a的盐酸c(H+)=10-a,pH=b的NaOH溶液c(OH-)=10b-14.
依题得:Va×10-a=Vb×10b-14, =10a+b-14.
①若a+b=14 =1;
②若a+b=13 =;
③若a+b>14 =10a+b-14>1, Va>Vb.
答案:(1)1 (2) (3)10a+b-14 >
12.(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3
 NH+NH.据此判断,以下叙述错误的是
NH+NH.据此判断,以下叙述错误的是
( )
A.液氨中含有NH3、NH、NH等粒子
B.一定温度下液氨中c(NH)·c(NH)是一个常数
C.液氨达到电离平衡时c(NH3)=c(NH)=c(NH)
D.只要不加入其他物质,液氨中c(NH)=c(NH)
(2)完成下列反应的化学方程式:
①在液氨中投入一小块金属钠,放出气体:__________________________________.
②NaNH2溶于水的反应:________________________________.
(3)类似于“H++OH-===H2O”的离子反应:_____________________________.
解析:(1)据可逆反应的特点知液氨存在NH3、NH与NH三种粒子,A正确;类比水的离子积可知B正确;液氨达到电离平衡时,各粒子的浓度不再改变 ,而非相等,C错误;因生成1 mol NH同时生成1 mol NH,故D正确.
(2)①类比Na与水的反应,可知Na投入到液氨中反应为2Na+2NH3===2NaNH2+H2↑.
②NaNH2与水发生复分解反应生成NaOH和NH3.
(3)完全类比即可写出NH+NH===2NH3.
答案:(1)C
(2)①2Na+2NH3===H2↑+2NaNH2
②NaNH2+H2O===NaOH+NH3↑
(3)NH+NH===2NH3
11.25℃时,水的电离达到平衡:H2O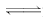
 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是
( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
解析:A项,稀氨水是弱碱,加入后水溶液中的c(OH-)增大,平衡逆向移动;B项,NaHSO4溶于水中电离使c(H+)增大,由于温度不变,故KW不变;C项,水中加入CH3COONa,CH3COONa发生水解,促进水的电离,使溶液呈碱性,c(H+)降低;D项,升高温度,水的电离程度增大,KW变大,pH变小.
答案:B
10.(2009·宁波联考)常温下,某酸HA溶液和某碱BOH溶液的物质的量浓度相同,两溶液混合后,溶液的pH=7,下列判断中合理的是
( )
|
编号 |
HA |
BOH |
溶液的体积关系 |
|
① |
强酸 |
强碱 |
V(HA)<V(BOH) |
|
② |
强酸 |
强碱 |
V(HA)=V(BOH) |
|
③ |
强酸 |
弱碱 |
V(HA)>V(BOH) |
|
④ |
弱酸 |
强碱 |
V(HA)>V(BOH) |
A.①③ B.②③
C.②④ D.①④
解析:强酸强碱混合呈中性,则体积相等,故① 错,②正确,若为③,当体积相等时生成强酸弱碱盐呈酸性,故V(HA)<V(BOH),错误;若为④,当体积相等时生成强碱弱酸盐呈碱性,故V(HA)>V(BOH),正确.
答案:C
9.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是
( )
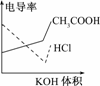
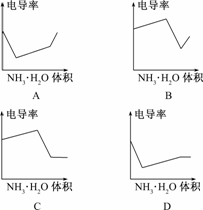
解析:加入NH3·H2O,先和较强的HCl反应,离子的物质的量并未增加,但离子物质的量浓度减小,电导率下降;随后NH3·H2O和较弱的CH3COOH反应,离子物质的量浓度增加,电导率上升;最后,加入的NH3·H2O不再反应,对原溶液稀释,电导率略有下降.
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com