
题目列表(包括答案和解析)
1.(2009·广州普通高中毕业班综合测试)海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是
( )
A.Br2在反应中表现氧化性
B.SO2在反应中被还原
C.Br2在反应中失去电子
D.1 mol氧化剂在反应中得到1 mol电子
解析:反应中氧化剂是Br2,得电子,并且1 mol Br2得到2 mol电子,还原剂是SO2,在反应中被氧化,故只有A正确.
答案:A
0.165 g×y 0.335 g
y=×100%=95.8%
答案:(1)3MnO2+6KOH+KClO33K2MnO4+KCl+3H2O
(2)3MnO+4H+===MnO2↓+2MnO+2H2O
(3)2.4 g
(4)2KMnO4+5Na2C2O4+8H2SO4===2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
(5)95.8%
2.5 g×80% x
x==2.4 g
(4)2KMnO4+5Na2C2O4+8H2SO4K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O.
(5)设该KMnO4的纯度为y,根据化学方程式可知:
KMnO4 - Na2C2O4
×158 g/mol 134 g/mol
22.(10分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.
请回答:
(1)由软锰矿制备K2MnO4的化学方程式是___________________;
(2)用K2MnO4制备KMnO4的离子方程式是___________________;
(3)若用2.5 g软锰矿(含MnO2 80%)进行上述实验,计算KMnO4的理论产量为________;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是________;
(5)上述制得的KMnO4产品0.165 g,恰好与0.335 g纯Na2C2O4反应完全,计算该KMnO4的纯度.
解析:(1)根据化合价升降法可得软锰矿与过量固体KOH和KClO3在高温下反应的化学方程式为3MnO2+6KOH+KClO33K2MnO4+KCl+3H2O;
(2)K2MnO4酸化得MnO2、KMnO4,离子方程式为3MnO+4H+===MnO2↓+2MnO+2H2O
(3)由上两小题的两个方程式可知,反应物和生成物之间的计量关系为:
MnO2 - K2MnO4 - KMnO4
87 158×
21.(9分)有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚显紫色.
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________.
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________________.此液体具有的性质是________(填写序号字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ.若2 mol该气体与2 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________.
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×1023个电子转移时,该反应的化学方程式是________.
解析:根据信息ZY3遇苯酚呈紫色,说明ZY3为FeCl3.则Y为Cl元素,Z为Fe元素. 又因为X2-与Cl-电子总数相同,所以X为S元素.
(1)Cl的最高价氧化物对应水化物的化学式为HClO4.
(2)FeCl3滴入沸水制得Fe(OH)3胶体.方程式为Fe3++3H2OFe(OH)3(胶体)+3H+,胶体具有丁达尔效应,可以发生电泳,将胶体加热蒸干得Fe(OH)3,灼烧得Fe2O3.故选择a、b、d.
向胶体中加入电解质可以聚沉,故c不正确.
(3)①S单质在空气中燃烧产生SO2气体.
物质燃烧放出的热量与燃烧物质的物质的量成比例变化.
所以列出关系式:
SO2 - ΔH
1 mol 98 kJ
x 176.4 kJ
∴x==1.8 mol,
产生176.4 kJ热量反应掉SO2 1.8 mol.
∴转化率为×100%=90%.
②由条件可知该反应为SO2与HClO3发生氧化还原反应,SO2被氧化为H2SO4,而HClO3在反应中被还原得到1 mol电子,所以其产物为ClO2,据得失电子守恒即可写出该化学方程式为SO2+2HClO3===H2SO4+2ClO2.
答案:(1)HClO4
(2)Fe3++3H2OFe(OH)3(胶体)+3H+ a、b、d
(3)①90% ②SO2+2HClO3===H2SO4+2ClO2
20.(9分)已知复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气.
(1)写出并配平发生反应的离子方程式________.
(2)该反应的氧化剂是________,还原产物是________________.
(3)该反应包含两种反应:①氧化反应为________转化为________,②还原反应过程的反应式为________.
(4)反应中1 mol臭氧________(填“得到”或“失去”)________mol电子.
解析:据题目可知该反应中是O3将KI氧化为I2,其中部分O3转化为O2,因此反应物中还有H2O,生成物中有KOH,据得失电子守恒不难写出化学反应方程式为O3+2KI+H2O===2KOH+I2+O2,所以氧化剂为O3,还原产物为KOH,还原反应为O3+H2O+2e-===2OH-+O2,因此1 mol O3得到2 mol电子.
答案:(1)O3+2I-+H2O===2OH-+I2+O2
(2)O3 OH-(或KOH)
(3)①I- I2 ②O3+H2O+2e-===2OH-+O2
(4)得到 2
19.(9分)(2009·黄冈秋季期末)A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、SO、CO两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管.
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液白色沉淀沉淀不溶解
C溶液白色沉淀沉淀不溶解
D溶液白色沉淀沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象.
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________.
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为__________________.
(3)③中若是向C溶液中滴入D溶液,可能出现的实验现象是________.
解析:分析4种阳离子和4种阴离子之间的关系可知CO只能与Na+结合成Na2CO3,则OH-只能与Ba2+结合成Ba(OH)2.对照实验②可知A为Ba(OH)2,生成的白色沉淀分别可能是BaCO3、Mg(OH)2、Al(OH)3、BaSO4,D溶液中生成的白色沉淀再加Ba(OH)2溶液后沉淀部分溶解,说明D是Al2(SO4)3.溶液B可能是Na2CO3或MgCl2,根据实验③可确定溶液B是MgCl2,则C是Na2CO3.(2)中沉淀部分溶解属于铝盐的性质.(3)中CO与Al3+发生双水解反应生成气体和沉淀.
答案:(1)Ba(OH)2 MgCl2 Na2CO3 Al2(SO4)3
(2)Al(OH)3+OH-===AlO+2H2O
(3)冒出大量气泡,同时生成白色沉淀
18.(8分)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价,下同),由铁酸盐MFe2O4经高温还原得到,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如下:
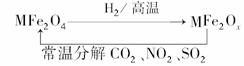
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________.
(2)在酸性溶液中,Fe2O易转化为Fe2+:
Fe2O+2e-+8H+―→2Fe2++4H2O
有K2MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平:________________________.
解析:(1)MFe2O4被还原时,MFe2O4与H2的物质的量之比为2∶1,根据电子守恒,则(3-)×2×2=2,x=3.5,即Fe在MFe2Ox的平均价态为+2.5价,则Fe2+和Fe3+物质的量之比为1∶1.
(2)要使Fe2O被还原,应选择具有还原性的物质,只能是Cu2O,反应的方程式为:
Fe2O+Cu2O+10H+===2Fe2++2Cu2++5H2O.
答案:(1)3.5 1∶1
(2)Fe2O+Cu2O+10H+===2Fe2++2Cu2++5H2O
17.(7分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色.
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是________(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,________是使溶液变黄色的物质.
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液
根据所学知识判断,________同学(填“甲”或“乙”)的推断是正确的,用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
解析:溴水通常呈现橙红色,滴入水中,能使水呈现黄色,但由于氧化性Br2>Fe3+,所以溴水能使Fe2+转化为显黄色的Fe3+,所以乙同学的推断是正确的.验证的方法可以向溶液中加入CCl4溶液,若有机层无色,说明溴单质已参与反应;或者向溶液中滴加硫氰化钾溶液,若溶液变红,说明单质溴与Fe2+已反应生成Fe3+.
答案:(1)Br2 Fe3+
(2)乙
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
C |
有机层无色 |
|
第二种方法 |
D |
溶液变红 |
16.(2009·长郡中学模拟)向10 mL 0.1 mol/L的CuSO4溶液中加入10 mL 0.15 mol/L NaOH溶液时,产生一种蓝色沉淀,溶液中的Cu2+几乎被沉淀完全,该蓝色沉淀的主要成分是
( )
A.Cu(OH)2 B.Cu2(OH)2CO3
C.3Cu(OH)2·CuSO4 D.Cu(OH)2·NaOH
解析:本题不能凭经验选A或B,应通过定量计算确定沉淀的组成. 反应前n(Cu2+)=1×10-3 mol,n(OH-)=1.5×10-3 mol,根据离子方程式Cu2++2OH-===Cu(OH)2↓可知反应后铜离子过量,但题干中告知溶液中的Cu2+几乎被沉淀完全,因此剩余的Cu2+只能与溶液中的阴离子SO结合成CuSO4并与Cu(OH)2一并形成碱式盐沉淀,所以选项C正确.
答案:C
第Ⅱ卷 (非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com