
题目列表(包括答案和解析)
11.(2009·上海单科高考)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
(3)根据上述反应可推知________________.
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
+
解析:此题为氧化还原反应题.
(1)此题考点为氧化还原反应,其特征为化合价升降,本质为电子的转移,要求能从化合价变化角度来判断氧化剂和还原剂.已知KBrO3为得电子物质,故其化合价必是降低,作氧化剂,那么还原剂只能是题目所提供的AsH3,AsH3中As为-3价,反应后变为H3AsO4,故还原剂为AsH3.
(2)此题出题的依据是氧化还原反应中得失电子守恒.0.2mol KBrO3在反应中得到1mol电子,故每1mol KBrO3得5mol电子,即反应后Br的化合价应降为零价,故另一物质为Br2,同时因为氧化剂、还原剂、氧化产物、还原产物已知,可直接进行配平.
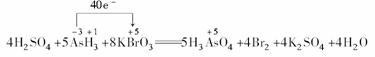
(还原剂) (氧化剂) (氧化产物) (还原产物)
根据化合价升降相等,则应在AsH3前配系数5,在Br2前配系数4,根据原子守恒KBrO3前配8;再根据K原子守恒,K2SO4应在生成物中,系数为4;则H2SO4在反应物中,系数为4;H2O在生成物中,系数为4;配平后用单线桥法标出电子转移方向和数目.
(3)此题的考点为氧化还原反应中的基本规律:氧化剂的氧化性大于氧化产物、还原剂的还原性大于还原产物.故选a、c.
答案:(1)AsH3 (2)Br2 (3)ac 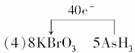
10.某化学兴趣小组做了一个如下图所示的实验,发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色,判断下列说法中正确的是
( )
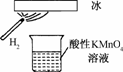
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了只具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
解析:酸性高锰酸钾溶液褪色,说明生成了一种具有还原性的物质,它又能使KSCN和FeCl2的混合溶液变红色,可见这一物质又具有强氧化性,所以只有选项D正确.
答案:D
9.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
SO2+2Fe3++2H2O===SO+2Fe2++4H+
Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
下列有关说法正确的是
( )
A.还原性Cr3+>Fe2+>SO2
B.氧化性Cr2O>SO2>Fe3+
C.Cr2O能将Na2SO3氧化成Na2SO4
D.两个反应中Fe2(SO4)3均作还原剂
解析:第一个反应中,Fe3+能将二氧化硫氧化,故其氧化性比SO2强,选项B错;第一个反应中,SO2为还原剂,Fe2+为还原产物,第二个反应中,Fe2+为还原剂,Cr3+为还原产物,根据还原剂的还原性强于还原产物的还原性,则还原性Cr3+<Fe2+<SO2,所以选项A错;Cr2O的氧化性强于Fe3+,而Fe3+能氧化SO2及其对应的酸和盐,故Cr2O能将Na2SO3氧化成Na2SO4,选项C正确;在第二个反应中,Fe2(SO4)3为氧化产物,选项D错.
答案:C
8.(2009·海南三亚模拟)已知:异氰酸(HCNO)结构式为H-N=C=O,其中氮元素为-3价.HCNO能和NO2反应生成N2、CO2、H2O.下列说法正确的是
( )
A.在反应中,HCNO既被氧化又被还原
B.在反应中,NO2是氧化剂,HCNO是还原剂
C.在反应中,NO2与HCNO的物质的量之比为1∶1
D.每生成1 mol CO2有4 mol电子转移
解析:由HCNO的结构式可知其中的C为+4价,N为-3价,反应方程式为
 反应中HCNO只作还原剂被氧化,NO2为氧化剂,每生成1
mol CO2有3 mol电子转移
反应中HCNO只作还原剂被氧化,NO2为氧化剂,每生成1
mol CO2有3 mol电子转移
答案:B
7.在复杂的体系中,确认化学反应先后顺序有利于解决问题.下列化学反应先后顺序判断正确的是
( )
A.在含等物质的量的AlO、OH-、CO的溶液中,逐滴加入盐酸:AlO、OH-、CO
B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:KOH、Ba(OH)2、BaCO3
D.在含等物质的量的Fe3+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Fe3+、Cu2+、H+
解析:判断化学反应先后顺序的原则是先发生反应的产物与其他物质不发生化学反应.A项,用假设法判断,若H+最先与AlO反应,生成氢氧化铝,而氢氧化铝与溶液中OH-反应生成AlO,故A错.B项,氯气的氧化顺序是I-、Fe2+、Br-,因为2Fe2++Br2===2Fe3++2Br-,故B错.C项,氢氧化钡先发生反应,因为碳酸钾与氢氧化钡不能共存,故C错.D项,氧化性顺序:Ag+>Fe3+>Cu2+>H+,D正确.
答案:D
6.钛(Ti)被称为继铁、铝之后的第三金属,由TiO2制取Ti的主要反应有:
①TiO2+2C+2Cl2TiCl4+2CO
②TiCl4+2Mg2MgCl2+Ti
下列叙述正确的是
( )
A.反应①是置换反应
B.反应②是复分解反应
C.反应①中TiO2是氧化剂
D.反应②中金属镁是还原剂
解析:在反应①中Ti的化合价不变,氧化剂为Cl2,A、C错误;反应②是置换反应,Mg是还原剂,B错误,D正确.
答案:D
5.(2009·浙江金华十校高三联考)现有M、N、P、E 4种元素的单质,能发生以下反应:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑
判断它们的还原性由强到弱的顺序是
( )
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
解析:根据①可知还原性M>N,根据③可知还原性N>E,而P能与冷水直接反应,故P的还原性最强,由此可得还原性P>M>N>E.
答案:B
4.(2009·深圳高三第一次调研考试)某溶液中含有①NO ②HCO ③SO ④CO ⑤SO等五种阴离子. 向其中加入少量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
( )
A.① B.①②④
C.①③⑤ D.①③④⑤
解析:Na2O2加入到水中,发生反应:2Na2O2+2H2O===4NaOH+O2↑,生成的NaOH和HCO反应如下:HCO+OH-===CO+H2O,使溶液中HCO减少,CO增多,并且Na2O2具有强氧化性,可以将SO氧化成SO,使SO减少,SO增多;溶液中只有NO的浓度基本不变,即A正确.
答案:A
3.(2009·青岛联考)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为
( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
解析:由NaClO3生成ClO2,Cl元素降低1价,Na2SO3作为还原剂,化合价将由+4价上升至+6价,升高2价,根据电子守恒规律,NaClO3与Na2SO3的物质的量之比为2∶1.
答案:B
2.(2009·临沂高三教学质量检查考试)离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是
( )
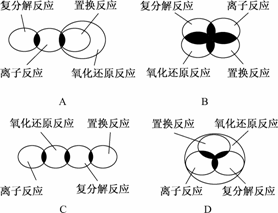
解析:置换反应都属于氧化还原反应;复分解反应、置换反应和氧化还原反应中均含有
离子反应;复分解反应一定不属于氧化还原反应.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com