
题目列表(包括答案和解析)
6.下列化学反应的离子方程式正确的是
( )
A.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
B.少量SO2通入Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.在稀氨水中通入过量CO2:
NH3·H2O+CO2===NH+HCO
D.氢氧化钙溶液与等物质的量的稀H2SO4混合:
Ca2++OH-+H++SO===CaSO4↓+H2O
解析:A项,稀HNO3能将-2价的S氧化;B项,HClO能将+4价S氧化;D项,离子方程式应为Ca2++2OH-+2H++SO===CaSO4↓+2H2O.
答案:C
5.离子方程式CO+2H+===CO2↑+H2O表示
( )
A.碳酸盐与盐酸之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与酸之间的反应
D.可溶性碳酸盐与强酸之间的反应
解析:CO只代表可溶性的碳酸盐,而H+只代表强酸而不是一切酸,如CH3COOH等弱酸应用分子式表示.
答案:D
4.下列离子方程式正确的是
( )
A.氯气通入冷水中:Cl2+H2O Cl-+ClO-+2H+
Cl-+ClO-+2H+
B.氨气通入醋酸溶液中:
CH3COOH+NH3===CH3COONH4
C.碳酸氢钙溶液中加入过量的氢氧化钠溶液:
HCO+OH-===CO+H2O
D.澄清石灰水与盐酸反应:H++OH-===H2O
解析:A选项错.Cl2与H2O反应生成物为HCl和HClO,其中HClO属弱酸,应写成分子;B选项错,在溶液中,生成物CH3COONH4属强电解质,应写成离子形式;C选项错,Ca(HCO3)2与过量的NaOH反应,Ca2+与HCO应全部参加反应,生成物有沉淀CaCO3,该选项违背事实,D选项符合题意.
答案:D
3.下列物质的导电性能最差的是
( )
A.熔化的NaOH B.1 mol/L H2SO4
C.0.1 mol/L醋酸 D.KCl固体
解析:前三项物质均能导电,而KCl固体中无自由移动的离子,不能导电.
答案:D
2.下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是
( )
A.FeBr2与Cl2
B.Ba(OH)2与H2SO4
C.HCl与Na2CO3
D.NaHCO3与Ca(OH)2
解析:B项,只发生反应Ba2++2OH-+2H++SO===BaSO4↓+2H2O;A项,Cl2少量时先氧化Fe2+,足量时Cl2将Br-、Fe2+都氧化;C项,H+少量时生成HCO,H+足量时生成CO2和H2O;D项NaHCO3少量时:HCO+Ca2++OH-===CaCO3↓+H2O,NaHCO3足量时:2HCO+Ca2++2OH-===2H2O+CaCO3↓+CO.
答案:B
1.下列物质的水溶液能导电,但属于非电解质的是
( )
A.CH3CH2COOH B.Cl2
C.NH4HCO3 D.SO2
解析:A、C为电解质,B既不是电解质,也不是非电解质.
答案:D
13.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)
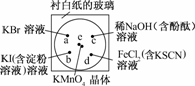
(1)e处反应的离子方程式为______________,该反应中发生反应的氧化剂和还原剂的物质的量之比为________.
(2)b处的实验现象为__________________,d处的实验现象为__________________.
(3)c处反应的化学方程式为____________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________ mol.
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是________.
解析:(1)根据e处发生反应的化学方程式判断反应中的氧化剂为KMnO4,还原剂为HCl,其中氧化剂和还原剂的物质的量之比为2∶10=1∶5,而不是1∶8.
(2)b处发生的反应为2KI+Cl2===2KCl+I2,I2遇淀粉显蓝色;d处发生的反应为2FeCl2+Cl2===2FeCl3,Fe3+和SCN-反应使溶液变红色.
(3)Cl2与NaOH溶液反应的化学方程式:
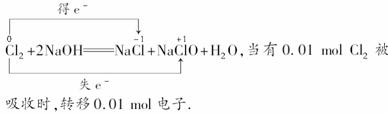
(4)e处实验说明氧化性KMnO4>Cl2,d处实验说明氧化性Cl2>FeCl3,因此,三种物质氧化性强弱顺序为KMnO4>Cl2>FeCl3.
答案:(1)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O 1∶5
(2)溶液由无色变为蓝色 溶液由无色变为红色
(3)Cl2+2NaOH===NaCl+NaClO+H2O 0.01
(4)能 KMnO4>Cl2>FeCl3
0.100 mol/L×0.100 L×=0.0150 mol.
V(Cl2)=0.0150 mol×22.4 L/mol=0.336 L.
答案:(1)①2 ②0.64 (2)0.336
0.2x mol×(4-)=0.4 mol,x=2
n(MnO)×5=0.4 mol
n(MnO)=0.08 mol
由电荷守恒可知:n(H+)×1-0.08 mol×1-0.2 mol×2=0.08 mol×2,故n(H+)=0.64 mol.
(2)FeBr2电离出的Fe2+和Br-都能被Cl2氧化,其反应方程式为2FeBr2+3Cl2===2FeCl3+2Br2,根据此化学方程式可知,2 mol FeBr2与3 mol Cl2完全反应,故至少需要Cl2
12.(2009·广东茂名调研)(1)已知下列变化过程中,0.2 mol RxO参加反应时,共转移0.4 mol电子.
RxO+MnO+H+―→RO2+Mn2++H2O
①x值为________.
②参加反应的H+的物质的量为________mol.
(2)在100 mL 0.100 mol/L的FeBr2溶液中通入Cl2,若要使反应完全,则至少需标准状况下Cl2________升.
解析:(1)由得失电子守恒可知:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com