
题目列表(包括答案和解析)
13.请按要求回答下列问题.
(1)请分别写出中学所学常见的强酸和强碱(各不少于3种)
强酸:__________________________________.
强碱:__________________________________.
(2)请写出中学所学常见的强氧化剂,其中属于单质的有________(不少于3种);属于化合物的有__________________________(不少于4种).
(3)请观察分析下列各组物质,指出各组物质具有的共同化学性质,每组各举一例,用化学方程式或离子方程式说明:
①H2SO4,H2SO3,H2S,SO2,CO2,Cl2,NH4Cl,FeCl3
共性______________________________________;
举例______________________________________.
②NaOH,Na2O,CaO,Na,Fe,Na2CO3,Na2S,Na2SO3
共性______________________________________;
举例______________________________________.
③Al,Al2O3,Al(OH)3,NaHCO3,NaHSO3,NaHS,(NH4)2S
共性______________________________________;
举例______________________________________.
解析:(1)中学中常见的强酸有HCl、H2SO4、HNO3、HBr、HI、HClO4.
常见的强碱有:NaOH、KOH、Ca(OH)2、Ba(OH)2等.
(2)中学常见的强氧化剂中,单质有Cl2、F2、Br2、O2等,化合物有HNO3、浓H2SO4、HClO、KMnO4等.
(3)①该组各物质均能与碱发生反应
例:NH4Cl+NaOH===NaCl+NH3·H2O
②该组各物质均能与酸发生反应
例:Na2CO3+2HCl===2NaCl+CO2↑+H2O
③该组各物质既能与强碱反应,也能与强酸反应.
例:NaHCO3+NaOH===Na2CO3+H2O
NaHCO3+HCl===NaCl+CO2↑+H2O,
答案:(1)HCl、H2SO4、HNO3 NaOH、KOH、Ba(OH)2
(2)Cl2、Br2、O2 浓H2SO4、HNO3、HClO、KMnO4
(3)①都能与碱反应
NH4Cl+NaOH===NaCl+NH3·H2O
②都能与酸反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
③既能与强碱反应,也能与强酸反应
NaHCO3+NaOH===Na2 CO3+H2O,
NaHCO3+HCl===NaCl+CO2↑+H2O
12.在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式_____________.
(3)最后溶液颜色加深,原因是________,此反应的离子方程式是____________.
(4)若用稀盐酸代替HI稀溶液,能出现上述哪些相同的变化现象?________.(写序号)
解析:HI既有酸性又有强还原性,I-能使Fe(OH)3胶粒聚沉,H+使其溶解,生成的Fe3+又能氧化I-成I2,而HCl只能使其聚沉然后溶解.
答案:(1)加入电解质后,使胶体聚沉
(2)Fe(OH)3+3H+===Fe3++3H2O
(3)有I2生成 2Fe3++2I-===2Fe2++I2
(4)(1)、(2)
11.已知淀粉溶于水后,淀粉粒子的直径在1 nm-100 nm之间.现有两个试剂瓶,其标签已模糊不清,只知道分别盛有淀粉溶液和氯化钠溶液,试用多种方法将其鉴别.
方法一:______________________________.
方法二:_____________________________.
方法三:_______________________________________.
解析:本题为开放性题目,方法较多.淀粉为胶体,可通过①丁达尔效应、②加热聚沉、③加入碘水变蓝等方面设计;NaCl溶液可通过①检验Na+、②检验Cl-、③导电性等方面设计.
答案:方法一:在水平方向上用激光笔照射两个试剂瓶,能够发生丁达尔效应的是淀粉溶液,余者为氯化钠溶液.
方法二:分别取1 mL未知溶液在两支试管中,然后分别滴入1-2滴硝酸银溶液,能够产生白色沉淀的为氯化钠溶液,余者为淀粉溶液.
方法三:分别取1 mL未知溶液在两支试管中,然后在酒精灯火焰上加热,出现糊状聚沉的是淀粉溶液,余者为氯化钠溶液.
另外的方法还有:导电法(氯化钠溶液导电、淀粉溶液不导电)、加入碘水(淀粉溶液呈蓝色)等.
10.将下列各组物质按酸、碱、盐分类顺序排列,正确的是
( )
A.硫酸、纯碱、石膏 B.氢硫酸、烧碱、绿矾
C.碳酸、乙醇、醋酸钠 D.磷酸、熟石灰、苛性钾
解析:纯碱是Na2CO3,属于盐;熟石灰是Ca(OH)2,属于碱;苛性钾是KOH,属于碱,而石膏和绿矾分别是CaSO4·2H2O和FeSO4·7H2O,属于盐,乙醇属于非电解质,故只有B正确.
答案:B
9.将淀粉碘化钾混合液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取杯中液体进行实验,能证明半透膜有破损的是
( )
A.加碘水变蓝色
B.加碘水不变蓝色
C.加AgNO3溶液产生黄色沉淀
D.加入氯水不变蓝色
解析:淀粉溶液属胶体,不能透过半透膜,K+、I-能透过半透膜.今要证明半透膜有破损,则证明淀粉也进入了烧杯中即可.加碘水溶液变蓝,说明半透膜有破损,A正确,B错误;C项不能证明有淀粉,错误;D项,加入氯水后,Cl2把I-氧化生成I2,若半透膜破损,则会变蓝,今不变蓝色,说明半透膜没有破损.
答案:A
8.Fe(OH)3胶体和MgCl2溶液共同具备的性质是
( )
A.两者均有丁达尔效应
B.两者均能透过半透膜
C.加入盐酸先沉淀,随后溶解
D.分散质粒子可通过滤纸
解析:MgCl2溶液无丁达尔效应;Fe(OH)3胶体不能透过半透膜;MgCl2溶液加盐酸无沉淀;Fe(OH)3胶体和MgCl2溶液的分散质粒子均可通过滤纸.
答案:D
7.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性.制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径在5.5-36 nm的磁流体,下列说法中正确的是
( )
A.所得的分散系属于悬浊液
B.该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3
D.给分散系通直流电时,阳极周围黑色加深
解析:分散质粒子直径在1-100 nm之间的分散系属于胶体,A错误.胶体能产生丁达尔效应,B正确.Fe2O3为红棕色,而磁流体为黑色,C错误.金属氧化物或氢氧化物胶粒带正电荷,电泳时阴极附近黑色加深,D错误.
答案:B
6.将10 mL淀粉胶体和5 mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如下图所示)2 min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是
( )
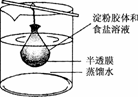
A.烧杯内液体加入硝酸银溶液后有白色沉淀产生
B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入硝酸银溶液后无变化
D.袋内液体加入碘水后不变蓝
解析:淀粉胶体不能透过半透膜,而较小的Cl-等能透过半透膜,且由于不是流动的水,因此半透膜内外的离子浓度保持相等,所以袋内、烧杯内的液体加入AgNO3溶液后均有白色沉淀生成;烧杯内溶液中加入碘水无现象,袋内溶液中加入碘水呈蓝色.
答案:A
5.盐是一类常用物质,下列物质可直接形成盐的是
( )
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥
C.只有②⑤⑥ D.全部
解析:金属与非金属化合可直接形成盐,如2Na+SNa2S,碱性氧化物和酸性氧化物可直接形成盐,如Na2O+SO3===Na2SO4,酸与碱中和可形成盐,如2NaOH+H2SO4===Na2SO4+2H2O,故选D.
答案:D
4.(2009·浙江理综高考)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是
( )
A.0.01mol·L-1的蔗糖溶液
B.0.01mol·L-1的CaCl2溶液
C.0.02mol·L-1的NaCl溶液
D.0.02mol·L-1的CH3COOH溶液
解析:据题意,1L溶液中,沸点高低取决于非挥发性溶质的分子或离子的数目.D项,CH3COOH易挥发而排除;A项,蔗糖是非电解质,溶液中只有0.01NA的蔗糖分子;B项,共有0.03NA的离子;C项,共有0.04NA的离子,故答案为C.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com