
题目列表(包括答案和解析)
4.充分燃烧一定量的丁烷生成CO2和液态水,放热Q kJ.经测定生成的CO2恰好被100 mL 5mol/L的KOH溶液吸收生成K2CO3,则热化学方程式:C4H10(g)+6.5O2(g)===4CO2(g)+5H2O(l)的ΔH为
( )
A.-16Q kJ/mol B.+16 Q kJ/mol
C.-8Q kJ/mol D.+8Q kJ/mol
解析:先求CO2的物质的量,由2KOH+CO2===K2CO3+H2O知n(CO2)=n(KOH)=×0.1 L×5 mol/L=0.25 mol.由生成0.25 mol CO2放热Q kJ,可知 1 mol C4H10完全燃烧生成 4 mol CO2放热 16Q kJ,因为是放热反应,故ΔH=-16 Q kJ/mol.
答案:A
3.氢气燃烧的热化学方程式,可用下列两种方程式表示:
2H2(g)+O2(g)===2H2O(l)+Q1 kJ
H2(g)+O2(g)===H2O(g)+Q2 kJ
Q1与Q2的关系为
( )
A.Q1=Q2 B.Q2>Q1
C.Q1>2Q2 D.Q1<2Q2
解析:反应中释放的能量既与参加反应的物质的量有关,又与物质的聚集状态有关,由于气态水液化要放热,故Q1>2Q2.
答案:C
2.下列变化中属于吸热反应的是
( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①② B.②③
C.①④⑤ D.②④
解析:放热反应有⑤,吸热反应有②④;液态水汽化是吸热过程,浓硫酸稀释是放热过程,均为物理变化。
答案:D
1.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为2221.5 kJ/mol,下列有关说法正确的是
( )
A.奥运火炬燃烧主要是将化学能量转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) ΔH=-2221.5kJ/mol
解析:根据能量守恒定律得出A项正确;B项,丙烷的相对分子质量小于正丁烷的相对分子质量,应是正丁烷的沸点高;C项,燃料电池中通入可燃性气体的一极应为负极;所谓燃烧热是指 1 mol可燃性气体完全燃烧生成稳定的氧化物所放出的热量,而D项中的H2O是气态,不是稳定氧化物。
答案:A
13.甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)===CO(g)+2H2O(g)
ΔH1=-443.64 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ/mol
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:______________________________________________.
(2)科研人员新近开发出一种由强碱作电解质溶液的新型甲醇手机电池,可使手机连续使用一个月才充一次电,据此回答:甲醇在________极反应.
 (3)利用电池可实现电能向化学能的转化.某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中不正确的是________(填序号).
(3)利用电池可实现电能向化学能的转化.某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中不正确的是________(填序号).
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解质溶液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是2H++2e-===H2↑
解析:(1)将第一个热化学方程式乘以2加上第二个热化学方程式可得:
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1453.28 kJ/mol
(2)由题意知,该电池为新型燃料电池,CH3OH发生氧化反应, 作原电池的负极.
(3)根据题意,白色沉淀较长时间不变色,电解时应该有还原性物质H2生成,使Fe(OH)2不易被氧化.电解时可以用NaCl溶液作为电解质溶液,此时阳极为铁电极,阴极可以不用铁作电极,阳极反应为Fe-2e-===Fe2+,阴极反应为 2H++2e-===H2↑.电解时a应为电源正极,b为电源负极,B极为电解池阴极,电解产生H2可将电解质溶液中溶解的O2排出,利于Fe(OH)2在较长时间内存在 .
答案:(1)2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1453.28 kJ/mol
(2)负 (3)C
12.CO、CH4均为常见的可燃性气体.
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是________.
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol.相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是__________________________.
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强.若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为________(保留2位小数).
解析:(1)CO转化成CO2:化合价从+2→+4;CH4转化成CO2:化合价从-4→+4;所以转移电子数之比为2∶8=1∶4.
(3)由方程式:2CO+O2===2CO2;
CH4+2O2===CO2+2H2O(g)
当耗O2和生成的CO2相同时,n(CO)∶n(CH4)=2∶1,可知CH4的体积分数是1/3=0.33;
答案:(1)1∶4
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-891 kJ/mol
(3)0.33
11.将煤转化为水煤气的主要化学反应为C(s)+H2O(g)===CO(g)+H2(g); C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ/mol
请回答下列问题:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:____________________.
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比 1mol C(s)完全燃烧放出的热量多.甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出如下列循环图:
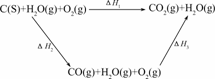
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”.
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”),判断的依据是
________.
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:
____________________、____________________.
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料.CO和H2在一定条件下可以合成: ①甲醇(CH4O) ②甲醛(CH2O) ③甲酸(CH2O2) ④乙酸(C2H4O2).试分析当CO和H2按1:1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.
解析:根据盖斯定律将方程式合并即可得C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ/mol,由此可知煤转化为水煤气是吸热反应,而甲正是忽略了这个问题,才误认为“煤转化为水煤气可以使煤燃烧放出更多的热量”.CO和H2按1:1反应合成物质时,可达到零排放,符合“绿色化学”的要求,则合成的物质满足最简式为CH2O,则②④符合.
答案:(1)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.5 kJ/mol
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3,且ΔH2>0)
(3)减少污染 燃烧充分 方便 直接燃烧水煤气热量大(答案合理即可)
(4)②③
10.利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q).已知:
①C7H8(l)(NBD)+9O2(g)===7CO2(g)+4H2O(l) ΔH1
②C7H8(l)(Q)+9O2(g)===7CO2(g)+4H2O(l) ΔH2
③  ΔH=+88.62
kJ/mol
ΔH=+88.62
kJ/mol
下列叙述不正确的是
( )
A.ΔH1>ΔH2
B.NBD的能量比Q的能量高
C.NBD比Q稳定
D.NBD转化为Q是吸热反应
解析:NBD转化为Q,ΔH>0为吸热反应,说明NBD能量比Q低,所以NBD比Q稳定.由①-②可得ΔH1-ΔH2=ΔH>0, ΔH1>ΔH2.
答案:B
9.已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.4 kJ/mol
下列结论正确的是
( )
A.炭的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀氢氧化钠溶液反应的中和热为-57.4 kJ/mol
D.稀醋酸与稀氢氧化钠溶液反应生成1 mol水,放出57.4 kJ热量
解析:A项中燃烧热要生成稳定的化合物,生成的CO可继续燃烧放出能量,所以炭的燃烧热大于110.5 kJ/mol;B项中反应热存在吸热和放热两种情况,应为ΔH=-221 kJ/mol;C项中和热反应表示为57.4 kJ/mol或ΔH=-57.4 kJ/mol;D项中醋酸的电离要吸热,放出热量减少.
答案:A
8.科学家研究南极冰芯样本后发现:工业革命前的65万年间,地球大气层中的温室气体稳定,CO2含量一直处于180-289 ppm之间,CH4含量在320-720 ppb之间.现在大气中的CO2和CH4含量分别高达380 ppm和1700 ppb,导致温室气体含量变化的主要原因是
( )
①以煤为能源的机器的广泛使用
②以石油为能源的机器的广泛使用
③以原子能为能源的核工业的发展
④以风能、太阳能为能源的新兴工业的发展
A.①② B.①③
C.②③ D.②④
解析:煤、石油在燃烧时会产生CO2,导致温室效应,①、②正确;核能和风能、太阳能为新能源且可再生,无污染,也不会产生温室效应,所以选A.
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com