
题目列表(包括答案和解析)
5.⑴H < C < N < O(2分),+2(1分),+3(1分),略
(2分)⑵sp2(1分)sp3(1分)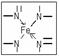 (2分)
(2分)
⑶4(1分)4:3(1分)68%(1分)体心立方(堆积)(1分)Na、K(2分,每个1分,答错倒扣)
3.(1)<(1分)
(2)C、N、O(2分,写出1个或2个得1分,3个全对得2分)
(3)b(1分)
(4)①1s22s22p63s23p63d8或[Ar] 3d8(1分)
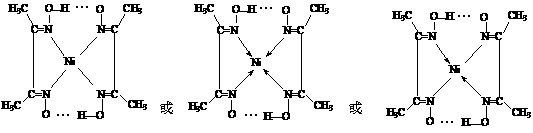
②(共3分,画全N-Ni键得1分,画全氢键得2分)
2.(1)⑨ (1分) (2)MgCNi3或CMgNi3(2分) (3)B D(2分)
(4)1(1分);三角锥形(1分);X和Y都是极性分子(且能形成氢键),根据相似相溶原理,极性分子易溶于极性溶剂中。(1分)
(5)D E F(3分);F(1分);B的np轨道上的电子半满,能量比A和C低,第一电离能比A和C大(1分)
1.(1)分子;1s22s22p63s23p63d84s2(2)7(3)ACE(4)①③④ ;平面(5)LaNi5
7.已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次
增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中
电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+
离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为
(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,
它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的
沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
6.氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 ;
 (2)N≡N的键能为946kJ·mol-1,N-N单键的键能为159 kJ·mol-1,计算说明N2中的
(2)N≡N的键能为946kJ·mol-1,N-N单键的键能为159 kJ·mol-1,计算说明N2中的
键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、
阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
(填“大”或“小”)
(4)X+中所有电子正好充满K、L、M三个电子层,它与
N3-形成的晶体结构如图所示。X的元素符号是 ,
与同一个N3-相连的X+有 个。
(5)N的最高价氧化物对应的水化物的稀溶液与Mg反应时,N被还原到最低价,该反应的化学方程式是 。
5.下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构。

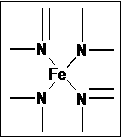
图甲:血红素的结构 图乙
回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是 ,根据以上电负性请判断H2N-CHO 中C和N的化合价分别为 和 。写出基态Fe原子的核外价电子排布式 。
⑵血红素中两种N原子的杂化方式分别为 ,在上图乙的方框内用“→”标出Fe2+的配位键。
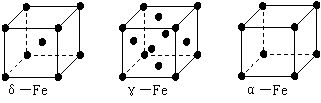
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 ;在δ晶胞中空间利用率为____________,其晶体的堆积方式的名称为 ,与其具有相同堆积方式的金属还有 (填元素符号)。
4.已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都
是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的氢化物A2H2分子的空间构型为__________,其中心原子采取的杂化形式为___________,分子中含有___________个 键,__________π键。
键,__________π键。
(2)写出化合物DC的电子式_______,E原子的核外电子排布式________。
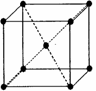 (3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,
易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶
体类型)。
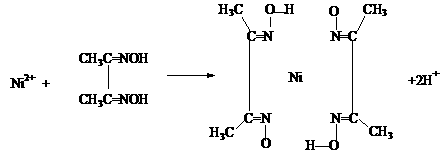
3.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:Al Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: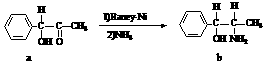
 化合物b中进行sp3杂化的原子有: 。
化合物b中进行sp3杂化的原子有: 。
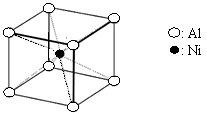
(3)一种铝镍合金的结构如下图,与其结构相似的
化合物是: (选填序号:
a.氯化钠 b.氯化铯 c.石英 d.金刚石)。
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红
色配合物沉淀。
①Ni2+在基态时,核外电子排布式为: 。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
2.下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
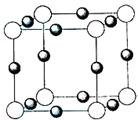
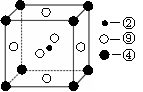 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是 (填字母),其中化合价为+3价的是 (填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com