
题目列表(包括答案和解析)
1..(共9分)
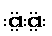 (1) (1分); MnO2+4HCl(浓)
(1) (1分); MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)4:1(1分); (3)①第4周期 Ⅷ族(1分);NO(1分); ②0.4a (1分)
(4)c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)(2分)
7.(天津市十二所重点学校高三联考)
下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问
题:
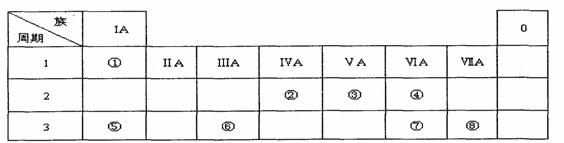
I.(1)请画出元素⑧的离子结构示意图 。
(2)元素⑦中质子数和中子数相等的同位素符号是 。
(3)④、⑤、⑦的原子半径由大到小的顺序为 。
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为 > 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为____。
II.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
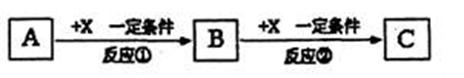
(1)若X是强氧性化单质,则A不可能是 (填序号)。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的化学试剂和现象分别是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式____ 。
(3)若A,B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式____ 。
第23题--推断题专项练习答案
6.. (福建莆田质检)(11分)A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是 。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为 。
(3)由A、D组成的最简单化合物甲的二氯化物有 种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为: 。
(4)已知反应:DE(g)+A2E(g) DE2(g)+A2(g),
DE2(g)+A2(g),
一定条件下该反应进行过程中的能量变化如右图表示,
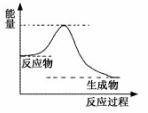 请结合右图判断:该反应△H 0(填“>”、“<”或
请结合右图判断:该反应△H 0(填“>”、“<”或
“=”)。该反应的平衡常数表达式为:K= 。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三
种溶液,水的电离程度由大到小的顺序为 。
5.(武汉高三理综)(15 分)
A、B、C、D均是前四周期元素组成的单质或化合物。它们之间有如下转化关系:

(1) 若A是某矿石的主要成份,上述转化关系表示工业生产D的过程,且反应②在接触室中进行,反应①在______(填设备名称)中进行。工业上使用______吸收C,以提高吸收效率。
(2) 若D是能使澄清石灰水变浑浊的无色无味气体,A、B为两种单质,组成它们的元素原子序数之和为18,②、③均为化合反应,则反应①中氧化剂与还原剂的质量之比为______
(3) 若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是______检验C中金属阳离子的常见试剂是______(填名称)。
(4) 若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______ (填字母)。
a. A可能是一种耐火材料;
b. B的溶液一定呈碱性;
c. C 一定既溶于盐酸又溶于苛性钠溶液;
则B与D在溶液中反应的离子方程式为________________________。
4.(哈尔滨九中高三模拟)
(14分)若X、Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):Xm + Yn + H2O → HXO3 + HY。请回答:
⑴该反应的还原剂的电子式为___________________。
⑵配平上述化学方程式(用化学式表示):
⑶若某化学反应如下:(未配平)KX + Yn + H2O → KXO3 + Xm + HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目:
KX + Yn + H2O →
⑷已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下:
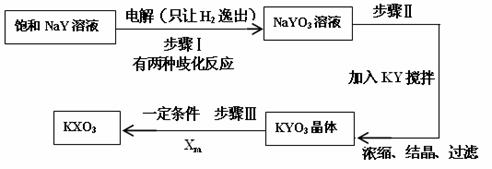
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示):______________________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3 mol·L-1的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1 mol·L-1。[已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变]
3.(琼海高三理综)(10分)已知A、B、C、D是单质,x、Y、z是化合物,它们之间有如下转化关系:
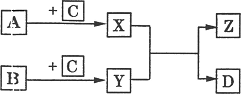
(1) 若C、D为同一种物质,则
①化合物z的组成元素 (用A、B、C表示)。
②反应X+Y →Z+D是否为氧化还原反应? (填“是”或“否’’),其理由是
③C元素在化合物X、Y中呈现的化合价,必定是在一种物质中呈正价,在另一种物质
中呈负价,此结论是否正确 ;请写出有关反应的化学方程式来证明你的结
论
(2)若B、D为同一种物质,写出反应X+Y →Z+D的化学方程式(若有多种情况,只写其中一种)
2.(山东济南高三质检)(11分 )A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2) 元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
已知(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
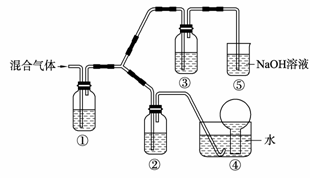 (ⅱ) NaOH溶液与BC2反应的化学方程式为:
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
 2NaOH+2BC2 NaBC2+NaBC +
H2O
2NaOH+2BC2 NaBC2+NaBC +
H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
1.(9分)A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是 ,该反应的化学方程式是:
。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是 。
7.(1)O>N>C(2分) (2)CH4、H2O、NH3(写出2种即可)(2分)
(3)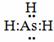 (1分) 极性(1分) NH3分子间能形成氢键而AsH3不能(2分)
(1分) 极性(1分) NH3分子间能形成氢键而AsH3不能(2分)
(4)1s22s22p63s23p63d24s2(2分) (5)大(1分)
6.(1)1s22s22p6;(2)π,σ;(3)小, (4)Cu,6
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com