
题目列表(包括答案和解析)
5.2010年全国I卷
2010年全国I卷创新点主要有:选择题中的第10题、第11题;主观题中的第27题(速率与平衡)、28题、29题(实验画图题)、30题(有机推断题)
创新试题预测5:有机主观题的命题形式可能发生变化
(1)有机选择题是有机框图题的一种变式,以后有机选择题可能会采用这种框图形式以增加有机知识的量。
(2)是否预示主观有机题的命题形式会发生变化呢?难道主观有机题只能用框图形式吗?
(3)命题勇于创新,近几年理综主观题中考复杂计算题、以反应原理为载体的推断题、电化学读装置图题、化学平衡读坐标图题、不考无机框图题等,都是创新;虽然这几年理综试题有这样或那样的问题,但命题人敢于创新的行为值得赞扬。
2010全国卷1第28题的特点:
(1)本题考查学生的分析推理能力,涉及到元素及其化合物的性质,离子反应,物质的检验,与量有关的反应不同、现象不同,同时考查 学生文字表达能力等;试题综合性强,难度大,区分度很好。
学生文字表达能力等;试题综合性强,难度大,区分度很好。
(2)本题是29、09年第29题的延续和创新,解题范围更为宽泛;这类试题可能会在探索中逐步成熟。
(3)目前以离子反应为载体的推断题,尚未涉及离子间的氧化还原反应。
4.2009年全国I卷
2009年全国I卷的创新点有:选择题中的第8题、主观题中的第27题(实验题)、第28题(电解原理及计算)。
创新试题预测4:更多试题地从“中观”上考查学生对基础知识的掌握情况
3.2008年全国I卷
2008年全国I卷中的创新点有:选择题中第8题;主观题中的第26题、28题。时隔二年又重新启用无机框图题:第27题。
创新试题预测3:考查学生书写陌生氧化还原反应的能力
考查学生书写陌生氧化还原反应的能力。书写陌生氧化还原反应的步骤是:
第一步:写出“氧化剂+还原剂=还原产物+氧化产物”
第二步:根据得失电子守恒配平上述反应
第三步:根据电荷守恒和反应溶液的酸碱性,补充H+、OH-、H2O等
第四步:根据质量守恒配平反应方程式
2.2007年全国I卷
2007年全国I卷的创新题是27题;选择题的新特点是有6道题(7、8、9、10、11、12)含有计算因素。
1.2006年全国I卷
2006年全国I卷创新题有:主观是中的第27题、第29题,主观题中第一次抛弃了无机框图题;选择题中基本无创新题。
创新试题预测1:考查学生有逻辑的搜索能力
创新试题欣赏:化学反应过程,包含反应物化学键的断裂和生成物化学键的形成,写出符合下列要求的化学方程式。
(1)只有非极性键断裂,只有极性键形成
(2)只断裂非极性键和极性键,只形 成非极性键和极性键
成非极性键和极性键
(3)反应过程中同时有离子键、极性键和非极性键的断裂和形成
(4)只断裂非极性键和极性键,只形成极性键
(5)只断裂共价键,只形成共价键和离子键
(6)只断裂共价键和离子键,只形成共价键
(7)只断裂极性键,只形成极性键和非极性键
创新试题预测2:考查学生的观察能力和微观想象能力
13.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____________________.
(2)W与Y可形成化合物W2Y,该化合物的电子式为____________________.
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:
__________________________________.
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
________________________________.
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示).
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________.
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:____________________________.
解析:依题意:4种元素在同一短周期中,由问题(1)知W、X中必有铝,因为Mg(OH)2难溶,不与Al(OH)3反应,再结合原子序数大小,可知W为Na,X为Al,由(2)知W与Y形成W2Y,说明Y为硫,组成Na2S,又因为Y的原子序数小于Z的原子序数,且W、Y、Z又位于同一周期,故Z为氯元素.
答案:(1)Al(OH)3+OH-===AlO+2H2O
(2)Na+[····]2-Na+
(3)酸 Al3++3H2OAl(OH)3+3H+
(4)SO2+Cl2+2H2O===H2SO4+2HCl
(5)HCl H2S (6)S2- Cl- Na+ Al3+
(7)Cl2O7(l)+H2O(l)===2HClO4(aq)
ΔH=-4Q kJ/mol
12.(2009·长春实验中学模拟)现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应.请回答:
(1)B和C的元素符号分别为________.
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为
______________________________.
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为
________________________.
(4)由A、B形成的化合物是一种大气污染物,可用足量D的最高价氧化物的水化物来除去,写出反应的化学方程式:________________________________________.
解析:抓住C的特征性质,可以判断C为Al,则B、D中必然有一种为Na[因为Mg(OH)2不与Al反应],因为B不可能为Na(由于A、B同主族,且A、B的原子序数之和等于Al与D的原子序数之和),所以D为Na.设A的原子序数为a,则B的原子序数为a+8,有关系式:a+(a+8)=13+11,所以a=8,即A为O,B为S.整个题目便迎刃而解.
答案:(1)S、Al (2)Na Al S O
(3)2Na2O2+2CO2===2Na2CO3+O2
(4)2OH-+SO2===SO+H2O
11.(2009·北京朝阳区综合检测)在当代,能源同信息、材料一起构成了现代文明的三大支柱.碳元素是能源领域的主角之一,材料和医学领域等也与碳元素息息相关.
(1)X、Y、Z是短周期中除碳元素之外的非金属元素,它们在周期表中分处于三个不同的周期且原子序数依次增大;X分别与Y和Z以原子个数比1∶1相结合时均可形成18电子的分子.请写出三个符合下列条件的化学方程式:
a.所有的反应物和生成物都由X、Y、Z及碳四种元素中的一种或两种组成;
b.反应物中有单质参加且只有一种,三个反应中的单质不同.
________________________________________;
________________________________________;
________________________________________.
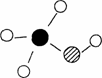 (2)由元素X、Y及碳组成的化合物A的球棍结构如右图所示:利用A、O2和KOH可组成燃料电池,则在该电池负极发生反应的物质是________,正极的电极反应式为
(2)由元素X、Y及碳组成的化合物A的球棍结构如右图所示:利用A、O2和KOH可组成燃料电池,则在该电池负极发生反应的物质是________,正极的电极反应式为
________________________________________.
解析:据题目条件可知X为H,Y为O,Z为Cl,
X与Y可形成H2O2,X与Z可形成HCl,这两个分子均有18个电子.
(1)符合条件的反应可有:
C+CO22CO或C+H2O(g)H2+CO;
CH4+O2CO2+2H2O或2CO+O22CO2;
CH2=CH2+H2催化剂△CH3CH3.
(2)该燃料电池由CH3OH、O2和KOH溶液组成,负极是CH3OH失电子,正极是O2得电子,正极反应为O2+4e-+2H2O===4OH-.
答案:(1)C+CO22CO或C+H2O(g)H2+CO
CH4+2O2CO2+2H2O或2CO+O22CO2
CH2=CH2+H2催化剂△CH3CH3
(2)CH3OH O2+4e-+2H2O===4OH-
10.据《自然》杂志报道,科学家最近研制的一种以锶原子做钟摆的钟是世界上最精确的钟.锶元素(元素符号为Sr)的原子结构示意图如图所示.下列说法不正确的是
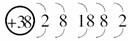 ( )
( )
A.氮化锶的化学式为Sr3N2
B.锶可与水反应生成H2
C.氢氧化锶[Sr(OH)2]为强电解质
D.Sr3N2、Sr(OH)2的熔、沸点均较低
解析:据原子结构示意图知Sr为第五周期第ⅡA族元素,故化合物中Sr显+2价,氮化锶的化学式为Sr3N2正确;因金属性:Sr>Ca,故Sr能与H2O反应而生成H2;碱性:Sr(OH)2>Ca(OH)2,所以B、C均正确;Sr3N2、Sr(OH)2应为离子化合物,熔、沸点较高,D错误.
答案:D
9.(2009·湖北荆州高中质检)下列结论正确的是
( )
①粒子半径:S2->Cl>S>F
②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I-
④单质氧化性:Cl2>S>Se>Fe
⑤酸性:H2SO4>HClO4>H2SeO4
⑥分散系中分散质粒子的直径:Fe(OH)3悬浊液>
Fe(OH)3胶体>FeCl3溶液
A.① B.⑥
C.②④⑥ D.①③④
解析:同周期,自左至右,原子半径逐渐减小,气态氢化物稳定性逐渐增强,离子还原性逐渐减弱,单质氧化性增强;同主族,自上至下,原子半径逐渐增大,气态氢化物稳定性逐渐减弱,离子还原性增强,单质氧化性减弱,故①③⑤错误,②④正确.又因为分散系中分散质粒子直径大小为浊液>胶体>溶液,故⑥正确,选C.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com