
题目列表(包括答案和解析)
28.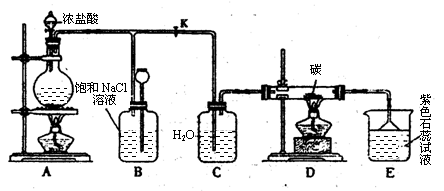 (16分)下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(16分)下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开 旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是
旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是  。
。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
27.下图中A--L均为中学化学中的常见物质,已知B、D、E、L常温下为密度比空气大的气体, D、E为单质,其他为化合物。G是一种淡黄色固体,F、G的焰色反应为黄色,F、G均能与L的水溶液反应放出B。
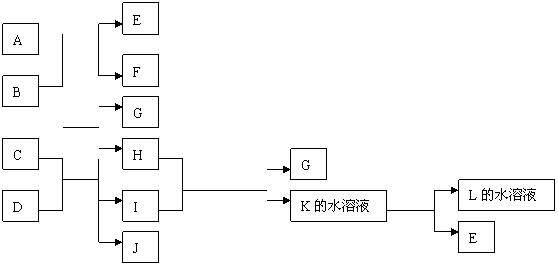
 ①
①





 ②
②
③
 通入过量B
通入过量B
④ 光照
⑤
试回答:
⑴写出G的化学式: ,B的电子是:


 ⑵ D是某化工生产的重要产品之一,该化工生产的名称是:
⑵ D是某化工生产的重要产品之一,该化工生产的名称是:
 ⑶写出A与L的水溶液反应的化学方程式:
⑶写出A与L的水溶液反应的化学方程式:
 ⑷某单质与C、L的水溶液均能反应放出氢气,写出该单质与C溶液反应的离子方程式:
⑷某单质与C、L的水溶液均能反应放出氢气,写出该单质与C溶液反应的离子方程式:
 ⑸反应①和反应
⑸反应①和反应 ⑤生成等量时转移的电子数之比为:
⑤生成等量时转移的电子数之比为:
 ⑹电解J的溶液的离子方程式:
_____________________________________。
⑹电解J的溶液的离子方程式:
_____________________________________。
26.(15分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)五种元 素的原子半径从大到小的顺序是 (用元素符号
素的原子半径从大到小的顺序是 (用元素符号 表示) ______________________________________。
表示) ______________________________________。
(2)X与Z形成的3∶1的化合物A,它与Z的最高价氧化物对应的水化物B反应的化学方程式______________________________________,该水溶液显_______性,用离子方程式解释原因_____________________________________。
(3)硒是人体必需的微量元素,与L同一主族,其最高价氧化物对应的水化物化学式为__________。该元素固体单质与H2反应生成0.5 mol气态氢化物时吸收了14.87kJ的热量,请写出1mol该物质与氢气化合的热化学方程式 。
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:_____________________________________;由R生成Q的化学方程式:_____________________________________。
13. 有100mLMgCl2和AlCl3的混合溶液,其中c (Mg2+)为0.1mol/L,c (Cl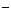 )为0.65mol/L,要使Mg2+转化为沉淀分离出来,至少需加1mol/L NaOH溶液体积是 ( )
)为0.65mol/L,要使Mg2+转化为沉淀分离出来,至少需加1mol/L NaOH溶液体积是 ( )
A.40mL B.60mL C.80mL D.120Ml
12.对于体积相同的①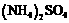 、②)NH4HSO4、③H2SO4溶液,下列说法正确的是( )
、②)NH4HSO4、③H2SO4溶液,下列说法正确的是( )
A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
C.溶液的pH相同时,由水电离出的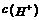 大小顺序是③>②>①
大小顺序是③>②>①
D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③
11. 据报道,一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
据报道,一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH- 2CO32-+6 H2O则下列说法错误的是( )
A.放电时CH3OH参与反应的电极为正极。
B.充电时电解质溶液的pH逐渐增大。
C.放电时负极的电极反应为:CH3OH +8 OH--6e-=CO32-+6 H2O
D.充电时每生成lmol CH3OH转移6mol电子。
10.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子半径是短周期元素原子半径最大的。则下列叙述正确的是 ( )
A.由A和C形成的一种化合物与C和E形成的一种化合物能发生氧化还原反应
B.由A、C原子构成的分子和B、D原子构成的分子电子数相等
C.B、D两种单质相互化合的反应是不可逆反应
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
9.
2010年3月29日莫斯科地铁发生连环爆炸,恐怖分子使用了“黑索金”军事炸药。“黑索金”是由乌洛托品(六亚甲基四胺,分子结构如下图)与发烟硝酸作用制得。下列说法中正确的是( )
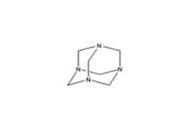
A.“黑索金”属于高分子化合物。
B.“黑索金”是由乌洛托品与硝酸发生酯化反应生成的。
C.乌洛托品的分子式为C6H12N4
D.乌洛托品分子结构中含有3个六元环。
8.设NA为阿伏加德罗常数,下列说法正确的是: ( )
 A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下, 22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1m ol氢气时,转移的电子数为NA
ol氢气时,转移的电子数为NA
7. 已知亚硫酸是二元弱酸,亚硫酸氢钠溶液呈酸性。在O.2mol·L-1的亚硫酸氢纳溶液中,下列关系正确的是 ( )
A.c(HSO3-)+c(SO32-)=0.2 mol·L-1
B.c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)
C.c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-)
D.c(SO32-)<c(H2SO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com